CORRESPONDENCIA
A. Cedeño-Zambrano
Servicio de Aparato Digestivo
Hospital Universitario Virgen Macarena. Sevilla.
agcz2@yahoo.com.mx
Caso clínico
Varón de 31 años, intervenido, 10 años antes, por un abdomen agudo con neumoperitoneo. El cirujano informó de una pequeña perforación a nivel prepilórico y realizó reparación de la misma, piloroplastia y vagotomía doble troncular. El estado general del paciente empeoró y el neumoperitoneo aumentó, por lo que se realizó 3 días más tarde una segunda laparotomía, en la que se detecta una perforación en la cara anterolateral del esófago distal. Se procedió al cierre de la perforación y a la práctica de una funduplicatura de Nissen. La evolución clínica no mejoró y el paciente desarrolló un estado séptico. Una tercera intervención 7 días después puso de relieve la persistencia de la perforación esofágica y la existencia de un empiema y un absceso pulmonar; se realizó una resección del lóbulo pulmonar inferior derecho, esofagectomía, dejando el esófago cervical y una gastrostomía de alimentación. Tras esta tercera intervención y tras una larga evolución clínica el paciente se recupera y es dado de alta. Tres meses después se realiza de modo programado, una coloplastia retroesternal, de colon derecho, con anastomosis isoperistáltica, termino-terminal al esófago cervical y término-lateral al estómago.
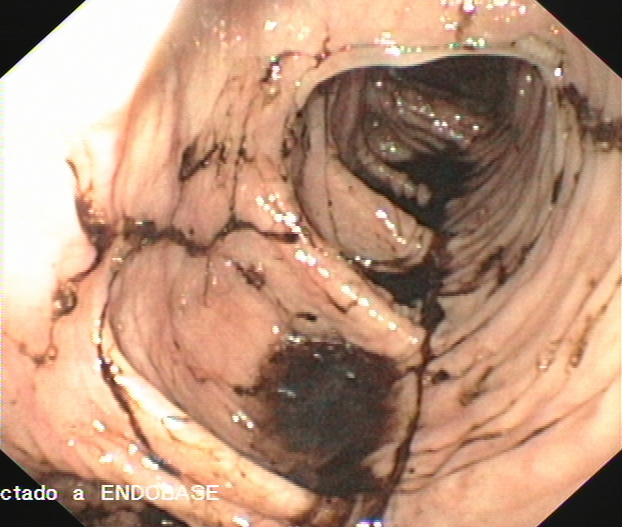
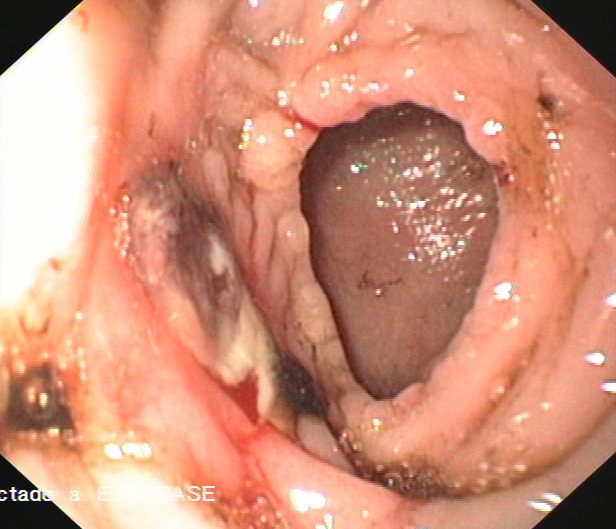
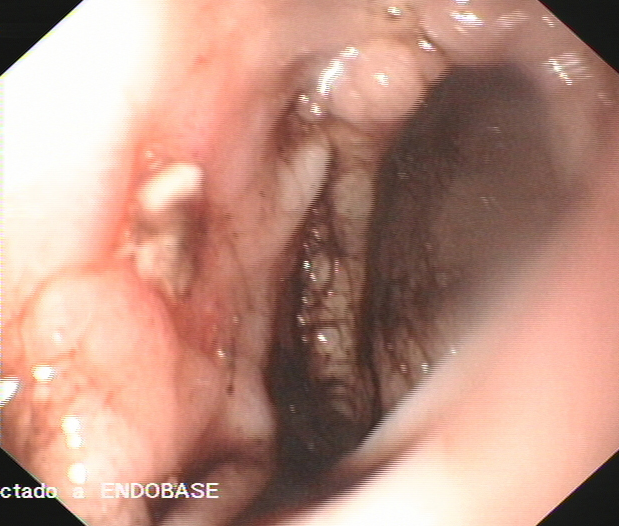
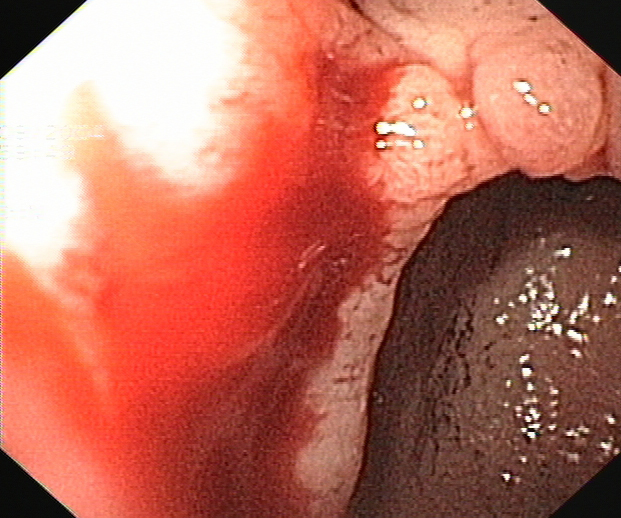
El paciente marchó de alta y evolucionó bien hasta 10 años después, fecha en la que ingresa por primera vez en el Servicio de Gastroenterología por melenas desde dos días antes. A su llegada presenta hipotensión arterial (70/40 mmHg) y anemia severa (hemoglobina 7.8 g/dl, hematocrito 23%). En una primera endoscopia se identifican abundantes restos hemáticos recientes en la plastia colónica y a unos 50 cm de arcada dentaria un sangrado en chorro, en la anastomosis cologástrica. Se realiza inyección de adrenalina y polidocanol, observándose hemostasia inmediata. No se encontraron otras lesiones sangrantes a nivel gástrico. A pesar del tratamiento continuaron las melenas y los episodios de hipotensión arterial, por lo que 24 horas después del ingreso se practica una segunda endoscopia oral. En ella se observan restos hemáticos digeridos en el segmento previo a la anastomosis y en la boca anastomótica, en la vertiente cólica, se identificó una úlcera de 1 cm, con fibrina y coágulo rojo adherido, sin sangrado activo; no se realizó terapia (Figuras 1 y 2). Durante los siguientes 6 días el paciente sigue con melenas y en una tercera endoscopia oral se observan restos hemáticos digeridos en el segmento colónico y en la anastomosis cologástrica persistía la úlcera, de menor tamaño, con fondo fibrinoso. En la anastomosis existía un tejido de granulación, friable, con signos de sangrado reciente, sobre el que se inyecta adrenalina y polidocanol (Figura 3). Tras 3 días sin melenas y en buena situación hemodinámica, reaparece el sangrado, que obliga, a los 15 días del ingreso, a practicar una nueva endoscopia. En esta se observa un sangrado activo severo en la úlcera de la anastomosis cologástrica, sobre la que se realiza esclerosis con adrenalina y polidocanol al 1% y se colocan tres hemoclips (Figura 4A y 4B) (Figura 5). A partir de ese día se produjo una hemostasia estable. Una semana después dos de los hemoclips se habían desprendido y la úlcera de la coloplastia se había reducido de tamaño y mostraba un fondo no hemático (Figura 6).
Figura 1
Endoscopia que se practicó durante las primeras 24 horas de estancia hospitalaria, y se observan restos hemáticos digeridos en injerto colónico.
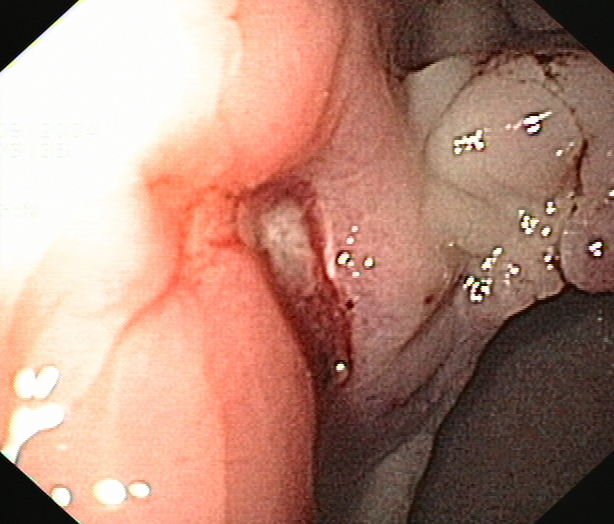
Figura 2
Segunda endoscopia que se realizó durante las primeras 24 horas, se observa en la anastomosis cologástrica una úlcera, en la vertiente colónica, con signos de sangrado no activo en su margen.
Figura 3
Endoscopia realizada al 6º día de hospitalización, en la que se aprecia persistencia de la úlcera en la anastomosis cologástrica, con signos de sangrado reciente, sobre el que se inyectó adrenalina y polidocanol.
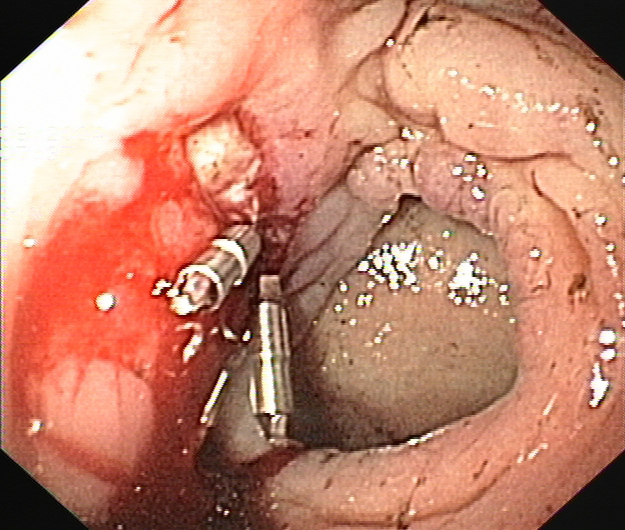
Figuras 4A y 4B
Endoscopia realizada a los 15 días del ingreso se observaba sangrado activo (A), procedente de la úlcera colónica de la anastomosis cologástrica (B).
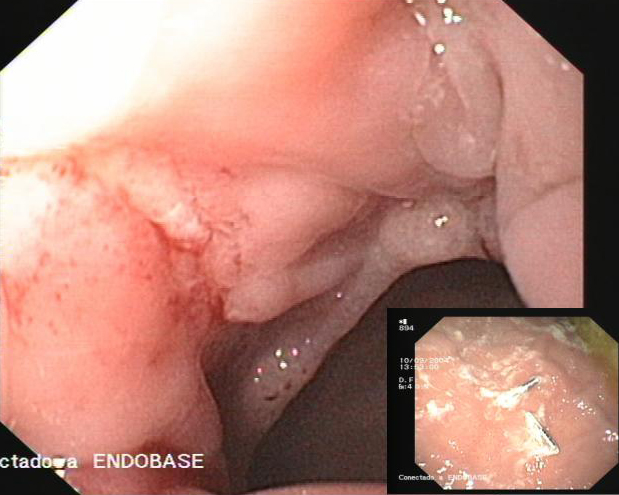
Figura 6
Una semana después dos de los hemoclips se habían desprendido y estaban alojados en cavidad gástrica (Recuadro). La úlcera de la coloplastia se había reducido de tamaño y mostraba un fondo no hemático.
El paciente había requerido durante su estancia hospitalaria, la transfusión de 6 concentrados de hematíes. Fue dado de alta y continúa bien clínica y endoscópicamente hasta 2010.
Discusión
Este paciente presentó una hemorragia digestiva por una úlcera de la boca anastomótica, que junto a la regurgitación y el reflujo gastrocólico, constituyen una de las complicaciones tardías de las anastomosis cologástricas, que son la modalidad de sustitución esofágica elegida en los casos de patología esofágica benigna y en pacientes jóvenes, esto es, cuando se supone que la anastomosis debe permanecer funcionante durante muchos años. La información sobre este tipo de complicaciones no es completa, dado que muchos estudios son retrospectivos y no explicitan la expresión clínica, ni las necesidades terapéuticas que imponen estas complicaciones, ni el método empleado para su diagnóstico. Algunos estudios incluso no mencionan el reflujo[1]-[3], o las úlceras como complicación tardía en las anastomosis cologástricas[1], [4], en series que suman 783 y 249 pacientes respectivamente, por citar solo algunos estudios recientes. De cualquier modo, la incidencia de reflujo gastrocólico es variable. En los estudios en que se valoran solo los síntomas puede ser alta, hasta de un 43%, pero con una buena respuesta simplemente con tratamiento médico[5], en otros estudios la incidencia es intermedia, del 27%, con una necesidad de corrección quirúrgica del 10%[6]. Pero en términos generales se admite una frecuencia de reflujo tras la anastomosis cologástrica del 8% al 15% y una tasa de resolución no quirúrgica de entre el 80% y el 100% de los casos[4], [7]. En algunos pacientes, cuando se ha hecho un seguimiento endoscópico o pHmétrico sistemático se han podido poner de manifiesto la existencia de reflujo ácido y colitis por reflujo asintomáticos[8]. En cualquier caso la frecuencia de problemas clínicos derivados del reflujo gastrocólico, es inferior a la que se observa cuando se utiliza una interposición gástrica. Esto ha sido motivo de diversos estudios sobre las razones naturales y técnicas, por la que esto ocurre. Se especula con el papel protector de la secreción mucosa por parte del injerto colónico, la resistencia de la mucosa del colon al pH ácido, mayor que la del esófago y la dinámica motora del colon distal, como mecanismo de aclaramiento del reflujo gastrocólico[9]. Desde el punto de vista técnico la realización de vagotomía y piloroplastia, el empleo de colon derecho como asa isoperistáltica y el tipo de anastomosis cologástrica, siendo preferible su establecimiento con la zona posterior del cuerpo gástrico, que con el fundus gástrico o el duodeno[7,10], son factores que predicen una menor incidencia de reflujo y úlceras colónicas en estos pacientes.
Las úlceras del área anastomótica son aún más infrecuentes que el reflujo, probablemente porque su formación sea un proceso más complejo. Generalmente las úlceras son únicas, radican en la vertiente colónica y se desarrollan entre 2 y 21 años después de la cirugía de sustitución esofágica. Hasta 1974 se menciona en la literatura médica una incidencia de 2.8-4.7%, sin que conozcamos mucho sobre sus aspectos clínicos[11]. En los años 80 se publican 6 casos, de las que disponemos de poca información, pero ya se menciona la necesidad de intervención quirúrgica en tres de los casos[12]-[15]; en uno de estos casos la úlcera anastomótica se perforó a ventrículo izquierdo y, tras una mala evolución, el paciente falleció a los dos años por causa no hemorrágica.
En los años 90 se empiezan a publicar datos sobre este tema en series, como la de Gerzic que encontró 3 casos de úlcera (1.13%), de los que 2 tuvieron que ser intervenidos y un enfermo posterior evolucionó bien con tratamiento antisecretor gástrico[16]. Pompeo en su serie en 1996 observó una úlcera en 51 (1.95%) casos de patología benigna, a los 96 meses de la intervención de sustitución gastrocólica; no sabemos los síntomas ni la evolución del paciente[17], pero ese mismo año Debras publicó un caso perforado a la aorta, que requirió tratamiento quirúrgico[18]. En 1997 Knezevic encuentra 4 casos de úlcera colónica (1.19%), 2 operados y 2 tratados médicamente[3]. En 1999 Jeyasingham en una serie de 365 (0.35%) casos de patología esofágica benigna observó solo 1 caso de úlcera colónica, que debutó con hemorragia masiva[9].
En la década de los 2000 hay 11 casos publicados, uno en 2002 de Domreis[19] que produjo una fístula colobronquial, resuelta mediante cirugía. En 2003 se publicaron 5 casos, en dos series que daban una incidencia de 0.25% y 1.15%, de los cuales cuatro sabemos que necesitaron cirugía[2], [20] y uno fue diagnosticado por endoscopia. Finalmente hay 5 casos más de úlcera colónica descritos que dan una incidencia[7] del 2% en 2010, que corresponde a un 11% de los que recibieron una anastomosis cologástrica, tres de ellos necesitaron ser operados por no evolucionar bien con antisecretores.
Así pues en los últimos 30 años se han publicado solo 33 casos de úlceras cólicas, incluyendo el presente caso, con una incidencia que va desde el 0.35% al 2% en distintas series, sin que se observe tendencia a la baja. En muchos casos la expresión clínica es el dolor, pero la evolución puede revestir mucha mayor gravedad, e inducir fístulas bronquiales, aórticas, o a ventrículo izquierdo y hemorragias digestivas masivas, o severas y persistentes, como en nuestro paciente. Aunque la información no es muy precisa, 17 casos de los 24 casos de los que tenemos información debieron ser intervenidos por fístulas, perforaciones o por hemorragia digestiva masiva en un caso. En 6 casos no se precisa el motivo de la intervención, mientras que en 7 casos la cirugía fue por mala repuesta al tratamiento antisecretor. Tres casos fueron tratados con éxito con tratamiento médico y, en nuestro caso, fue necesario el empleo conjunto de tratamiento endoscópico y medico.

 Descargar número completo
Descargar número completo Download full issue
Download full issue