CORRESPONDENCIA
Patricia Cordero Ruiz
Calle Padre Manjon 6, 1-1. Sevilla 41003. T
Teléfono fijo: 955008801
Teléfono móvil: 662168520
Fax: 955008805
rioga_patri@hotmail.com
Introducción
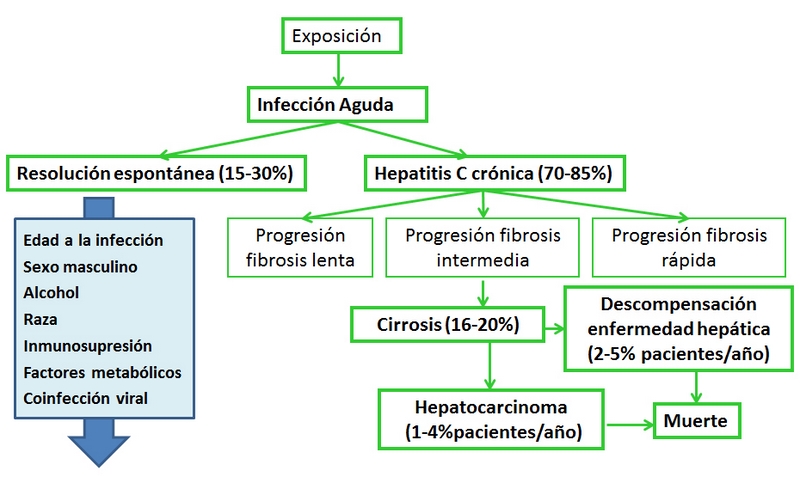
La hepatitis C es una enfermedad relativamente frecuente. Se ha estimado una prevalencia global de 130-210 millones de personas infectadas de forma crónica por el virus de la hepatitis C (VHC), lo que supone aproximadamente el 2,2 - 3% de la población mundial[1]. Es la principal causa de de hepatitis crónica y supone un problema de salud importante en el mundo occidental. Se estima que solo entre el 15-30% de los sujetos que tienen contacto con el VHC logran aclararlo espontáneamente. En el resto, la infección cronifica y progresará durante décadas, hasta que un 15-20% evolucionan a cirrosis hepática[2]. Sin embargo, la progresión de la fibrosis no es lineal a lo largo del tiempo, pudiendo estar acelerado este proceso por numerosos factores exógenos (Figura 1)[3]. Una vez establecida la cirrosis hepática, la probabilidad acumulada de presentar un episodio de descompensación clínica (ascitis, hemorragia digestiva alta secundaria a varices, síndrome hepatorrenal y encefalopatía hepática) durante el primer año de evolución es del 5% y aumenta con la progresión de la enfermedad, alcanzando valores del 30% a los 10 años. El riesgo de desarrollar hepatocarcinoma (CHC) oscila entre 1-4% pacientes/año[4]. Además la infección crónica por VHC se asocia a un aumento de la mortalidad de causa hepática frente a aquellos que aclaran la infección y recientemente se ha demostrado también un aumento de la mortalidad de causa no hepática[5], [6]. Desde que en 1986 se iniciara de forma empírica el tratamiento con interferón, hemos asistido a un incremento considerable y progresivo en las tasas de repuesta sostenida, que con la terapia con interferón pegilado y ribavirina se sitúan en torno a un 50% de forma global y con la reciente aparición de los inhibidores de la proteasa se consiguen incrementar hasta más del 70% las posibilidades de respuesta[7], [8]. El principal objetivo del tratamiento es conseguir respuesta virológica sostenida (RVS), definida como la ausencia de RNA-VHC detectable en suero 24 semanas tras la finalización del tratamiento, con el fin de evitar la progresión de la enfermedad, el desarrollo de complicaciones y la mortalidad asociada. El propósito de esta revisión es exponer la evidencia existente sobre el impacto del tratamiento antiviral en la persistencia de la RVS y los resultados a largo plazo de la misma, incluyendo el impacto en la fibrosis hepática, desarrollo de CHC y supervivencia.
Erradicación del virus de la hepatitis C
No está claro si la RVS supone la erradicación del virus C, los datos de la literatura son contradictorios, estas diferencias podrían explicarse por las diferencias técnicas y de sensibilidad de los métodos de detección del RNA-VHC o por las distintas muestras analizadas (suero, tejido hepático o células de sangre periférica). El VHC es principalmente hepatotropo, no obstante puede invadir y replicarse en células inmunes, de hecho se estima que el 3% de los viriones están en reservorios extrahepáticos. Cuando se analiza el RNA-VHC en tejido hepático, tras alcanzar RVS, la mayoría de los estudios con distintos regímenes de tratamiento (interferon en monoterapia o en combinación con ribavirina) solo lo detecta en el 2% de los pacientes[9]. Un estudio reciente detectó RNA-VHC en 19/20 muestras de tejido hepático tras RVS y en 13/20 células mononucleares de sangre periférica. Se utilizó una determinación de reacción en cadena de la polimerasa (PCR) en tiempo-real. Las biopsias se tomaron entre 8-117 meses tras alcanzar RVS, lo que apoya que la persistencia del VHC no se relaciona con el tiempo transcurrido desde el final del tratamiento[10]. A diferencia de estos datos, Maylin y cols. solo detectaron RNA-VHC en tejido hepático a 2/114 pacientes con RVS (se tomaron las biopsias entre 1-6 años tras finalizar el tratamiento) y no se detectó RNA-VHC en las células mononucleares de sangre periférica, utilizando una amplificación mediada por transcripción[11],. La diferencia entre estos estudios podría deberse al uso de distintos métodos de determinación del RNA-VHC, distintas formas de preservar y mantener las muestras, y diferentes intervalos de tiempo entre la extracción de las muestras y las determinaciones. No obstante se apreció una mejoría histológica en las muestras hepáticas y una normalización mantenida de las enzimas hepáticas, en ambos estudios por lo que aunque la replicación viral en el hígado y las células mononucleares de sangre periférica pueden mantenerse años después de finalizar el tratamiento antiviral, la recidiva virológica tardía tras la RVS es rara, por tanto parece que la persistencia y determinación del VHC en tejido hepático y en mononucleares de sangre periférica tienen poca utilidad clínica. Se desconoce si la persistencia de VHC tras la RVS podría tener capacidad infectiva en humanos, como se ha demostrado in vitro, no obstante hasta la fecha no se conoce ningún caso comunicado en humanos[12].
En pacientes con compromiso del sistema inmune (trasplantados, enfermos renales crónicos, tratamientos inmunosupresores e infecciones por VIH) que tienen RVS no se han demostrado mayores tasas de recidiva virológica tardía, siendo los datos comparables a los de inmunocompetentes.
Durabilidad de la RVS
La durabilidad de la respuesta después de los 6 meses de haber finalizado el tratamiento es una cuestión crucial sobre la eficacia real de la terapia antiviral en la hepatitis C. Generalmente los pacientes que alcanzan RVS tras el tratamiento se consideran curados de la infección viral, sin embargo el significado clínico de la detección del RNA-VHC en células mononucleares de sangre periférica y/o en tejido hepático, como ya se ha comentado, no está claro, si bien podría reflejar el aclaramiento prolongado de los residuos virales en estos compartimentos[13]. Con gran disparidad en los estudios (edad, sexo, genotipo, histología previa, terapia, dosis y tiempo de seguimiento clínico), son muchas las series que analizan la frecuencia y circunstancias de la recaída virológica tardía tras alcanzar la RVS, siendo las cifras de esta, baja en torno al 3% (Tabla 1) y sólo algunos estudios puntuales han mostrado cifras superiores[14]. En la serie de Pham y cols. 15/17 (88%) de los pacientes con RVS presentaron niveles de RNA-VHC detectables cuando se utilizó una técnica de elevada sensibilidad, que habían pasado desapercibida para la técnica habitual (menos sensible)[15]. En estudios más recientes con mayor número de pacientes, las cifras de recidiva virológica tardía son muy bajas, oscilando entre el 0-4%[11]. George y cols en 150 pacientes con RVS detectaron RNA-VHC durante el seguimiento a 9 pacientes, utilizando un método de amplificación isotérmica mediada por transcripción (cuyo límite de detección es <5,3 UI/mL) en una única medida en suero que no se confirmó en determinaciones posteriores en ninguno de ellos[16]. Todo indica que la mayor sensibilidad de los nuevos métodos de detección del RNA viral puede haber contribuido a una disminución de la recaída virológica tardía, pudiéndose afirmar que la RVS es duradera e indica erradicación de la infección viral.
Tabla 1
Tabla 1. Durabilidad del RNA-VHC indetectable tras RVS
Consecuencias clínicas de la Respuesta Virológica Sostenida
Diversos estudios muestran mejoría del pronóstico en pacientes con RVS a terapia antiviral, asociándose con cambios analíticos e histológicos, así como una disminución de complicaciones y de mortalidad en pacientes cirróticos, frente a los pacientes sin respueta al tratamiento[11,16-18].
Bioquímica
Los pacientes con RVS muestran en su seguimiento una remisión bioquímica favorable, siendo significativamente menores los valores de Transaminasas que persisten tras el tratamiento en comparación con las cifras pretratamiento[17,19]. De persistir hipertransaminemia tras alcanzar la RVS es obligado descartar enfermedad hepática concomitante[16]. También se ha demostrado un descenso de los valores de fosfatasa alcalina y GGT así como la mejora de niveles de plaquetas en pacientes cirróticos, por lo que el beneficio bioquímico no solo se limita a pacientes no cirróticos[11,20].
Histología hepática
Los efectos beneficiosos de la RVS sobre la histología hepática tras terapia con interferon, han sido ampliamente estudiados, demostrándose en biopsias hepáticas de control mejoría en la necroinflamación, fibrosis y esteatosis de los pacientes con RVS siendo menos frecuente la normalización histológica.
Los cambios histológicos están estrechamente ligados con el tiempo que transcurre entre el fin del tratamiento y la realización de la biopsia hepática posterapéutica, así en pacientes sometidos a monoterapia con interferon, en el estudio comparativo de biopsias entre 6 meses y un año posterapia, se aprecia una reducción significativa de la necrosis periportal e inflamación portal, sin cambios significativos en la fibrosis[21]. Estos datos se confirman en estudios posteriores y cuando se utilizan los regímenes de tratamiento que fueron apareciendo progresivamente con interferón pegilado y ribavirina[22]-[24]. La mejoría más llamativa se aprecia en la hepatitis periportal e inflamación portal que alcanza valores del 94% y del 82% respectivamente, siendo menor la mejoría de la necrosis (69%), tras seguimientos histológicos a largo plazo (5 años de media) (16). La proporción de pacientes que mejoran en las puntuaciones de necro-inflamación se correlacionan con el tiempo transcurrido entre la finalización del tratamiento y la toma de la biopsia hepática, es decir con la duración de la erradicación viral. Puesto que la mejoría histológica muestra un patrón lento, gradual y progresivo en el tiempo, cuando las biopsias se toman tras periodos inferiores al año del fin de tratamiento se consiguen mejorías en el 57% frente a cifras de hasta el 89% cuando se toman tras periodos medios superiores a los tres años[11], [22].
Las tasas de progresión de la fibrosis hepática se reducen en aquellos que alcanzan RVS tras el tratamiento, incluso algunos estudios han demostrado la regresión de la fibrosis, siendo la RVS una variable independiente asociada con la ausencia de fibrosis hepática significativa en las biopsias tras tratamiento[22], [24]. Varios estudios han demostrado la mejoría de la fibrosis hepática tras alcanzar RVS, sin embargo esta mejoría no es inmediata puesto que la eliminación del tejido fibrótico es un proceso lento que puede durar años. Cuando se comparan los resultados de estos datos a lo largo del tiempo se confirma que la regresión de la fibrosis aumenta con el tiempo tras la toma de biopsias después de finalizar el tratamiento. Con mejorías del 29%, 44%, 59% y 82% en biopsias tomadas tras una media de 1,6 años, 2,5 años, 3,7 años y 5,2 años respectivamente en comparación con la biopsias pretratamiento[16] (Tabla 2). El beneficio histológico es significativamente mayor cuando se administra tratamiento combinado (interferón-ribavirina) frente a la administración de interferón en monoterapia[24].
Tabla 2
Tabla 2. Cambios en la fibrosis hepática en pacientes con hepatitis C crónica y RVS.
La posibilidad de regresión de la cirrosis hepática ha sido y es motivo de debate en la actualidad. La base científica para la regresión de la cirrosis puede justificarse por la biología de la respuesta hepática a la cicatrización de heridas. La fibrosis representa un equilibrio entre la matriz extracelular hepática (formación de cicatriz) y degradación de matriz patológica, en los periodos en que no hay daño hepático se eliminan estos depósitos de fibrosis pero algunos no regresan, especialmente si la matriz de colágeno es muy reticulada o el tejido contiene bandas gruesas de colágeno. Esto podría explicar por qué no sería reversible la cirrosis en algunos pacientes[25]. Debemos tener en cuenta que la regresión de la cirrosis es un diagnóstico histológico basado en la toma de biopsias hepáticas desde un estadio cirrótico a uno no-cirrótico, por lo que la presencia o ausencia de cirrosis determinada por una única muestra puede no ser fiable, incluida la posibilidad de errores de muestreo debido a que la distribución de la fibrosis es heterogénea y a la variabilidad interobservador. Además la regresión de la fibrosis no tiene por que asociar regresión de otras alteraciones presentes en el hígado cirrótico, como la distorsión de la arquitectura y la alteración en la vascularización hepática, que podrían no ser valoradas con exactitud con las pequeñas agujas de biopsia[26] .
Sin embargo varios estudios, incluyendo un metaanálisis, en los que se comparan biopsias hepáticas antes y después del tratamiento antiviral demuestran que la regresión de la cirrosis puede ocurrir en algunos cirróticos[22], [27], siendo la regresión a estadios de fibrosis F3 lo más frecuente mientras que la regresión a estadios menores de fibrosis es más rara[11], [28], [29] (Tabla 3). Destacar que estos estudios utilizan distintos intervalos de tiempo entre la finalización del tratamiento y la toma de la segunda biopsia, que suele ser corto, por tanto es posible que esta regresión de la cirrosis pueda ir aumentando progresivamente con el tiempo y mejorando las tasas de reversibilidad en pacientes con RVS. En varios estudios se ha observado como la regresión de la cirrosis se relaciona estrechamente con la RVS y parece que esto es más frecuente en pacientes más jóvenes, lo que sugiere que estadios más precoces de cirrosis tienen mayor posibilidad de regresar que cirrosis de mayor tiempo de evolución y por tanto más establecida[24], [27].
Tabla 3
Tabla 3. Regresión de la cirrosis hepática (mediante biopsia hepática) en pacientes con RVS.
Eventos clínicos
Los pacientes con hepatitis crónica C se mantienen asintomáticos o con mínimos síntomas, como fatiga y debilidad, hasta estadios avanzados de la enfermedad. Sin embargo estudios utilizando cuestionarios validados, demuestran que los pacientes con hepatitis C crónica tienen peores resultados en los cuestionarios de calidad de vida, tanto en las puntuaciones físicas, sexuales como mentales. Estos resultados son peores en cirróticos y aquellos con hepatitis crónica C en estadio no cirrótico frente a los que alcanzan RVS y son independientes del valor de la ALT siendo el único determinante del resultado el estadio de la hepatitis crónica[30].
Más importante es la mejoría clínica que se asocia a la RVS en pacientes con fibrosis avanzada o cirrosis compensada, principalmente cuando la respuesta al tratamiento se asocia de una regresión de la cirrosis hepática[31], [32]. En estudios que realizan seguimiento a largo plazo (entre 2 y 8 años de media) se ha demostrado una reducción significativa en la aparición de eventos clínicos (Tabla 4) como son el desarrollo de ascitis, hemorragia por varices esofágicas, ictericia y encefalopatía hepática en el grupo que alcanza RVS frente a aquellos que no responden al tratamiento, aunque en una serie 192 pacientes con RVS (con fibrosis avanzada o cirrosis), 4 desarrollan un episodio de descompensación tras un seguimiento medio de 8 años[31] y en otra de 156 cirróticos con RVS, 6 de ellos desarrollan un episodio de descompensación tras un seguimiento medio de tres años, este último grupo incluyó todos los pacientes con cirrosis y con peor Child-Pugh[33]. Deuffic-Burban y cols. han creado un modelo para predecir la reducción en la incidencia de cirrosis por VHC y su mortalidad en varios países europeos teniendo en cuenta el impacto del tratamiento antiviral, tanto el tratamiento combinado como la triple terapia, hasta el año 2021. Desde 2002 al 2011 estiman una reducción de la incidencia acumulada de cirrosis del 7,1% y de la mortalidad del 3,4% con terapia combinada. Tras la introducción del la triple terapia se estima una mayor reducción, dado que las tasas de RVS son mayores, en la cirrosis del 17,7% y en la mortalidad del 9,7% desde el 2012 al 2021[34].
Tabla 4
Tabla 4. Resultados clínicos en pacientes cirróticos según la respuesta al tratamiento.
El riesgo de desarrollar CHC disminuye, sin embargo no desaparece a pesar de negativizar la viremia, tras periodos variables de tiempo de seguimiento y parece que el riesgo es menor cuanto mayor tiempo de evolución tras alcanzar la RVS, variando la probabilidad de desarrollarlo según la serie[20], [32], [35]. Shiratori y cols. observaron en cirróticos tratados con interferón en monoterapia tras un seguimiento medio de 8 años, una incidencia anual de desarrollo de CHC del 2,5% en los que alcanzaron RVS frente al 5% en el grupo NR[35]. Estos datos coinciden con los procedentes de otro metaanálisis reciente, donde los pacientes cirróticos con RVS tenían una reducción del riesgo de CHC en comparación con los no respondedores (RR 0,35, IC 95%, 0,26; 0,46)[36]. Por lo que estos resultados subrayan que el riesgo de desarrollar CHC persiste y es necesario continuar el despistaje periódico con pruebas de imagen y alfafetoproteína en pacientes cirróticos incluso tras alcanzar RVS.
Cuando se analiza la supervivencia a largo plazo, en pacientes con infección crónica por VHC, en un metaanálisis europeo tras 5 años de seguimiento, los datos son comparables entre pacientes con RVS y la población general. Esto también ocurre en aquellos con aclaramiento espontáneo de la hepatitis C. Destacar que este estudio solo incluyó 15 pacientes cirróticos de un total de 286[37]. Estudios realizados con pacientes en estadio cirrótico comparando los respondedores frente a no respondedores al tratamiento combinado obtienen una reducción significativa de la mortalidad de causa hepática. Van der Meer y cols además encuentran una reducción significativa no solo de la mortalidad de causa hepática, sino de la mortalidad por otras causas en pacientes con fibrosis avanzada y RVS frente a no respondedores, obteniendo una reducción del riesgo de 0,26 (HR 0,26, 95% IC, 0.14-0.49, p< .001) de la mortalidad por otras causas y del 0,06 (HR, 0,06, 95% CI, 0.02-0.19; P<.001) de la mortalidad de causa hepática en RVS[20]. Con la introducción de la triple terapia se estima una reducción más significativa de estas tasas de mortalidad asociadas a una mayor tasa de RVS[34].
Conclusiones
En la infección crónica por VHC, la RVS inducida tras el tratamiento antiviral es duradera en la gran mayoría de los pacientes. La RVS es un marcador de erradicación viral, puesto que la evidencia de residuos virales no ha demostrado tener significación clínica. Los beneficios a largo plazo del tratamiento antiviral incluyen una mejoría en la histología hepática, con una reducción importante de la necroinflamación así como de la fibrosis aunque más lenta pero progresiva, con reversión incluso de la cirrosis en algunos casos. Mejora la calidad de vida en pacientes con fibrosis avanzada y cirróticos en los que además reduce la incidencia de descompensaciones clínicas, de CHC y mejora de la supervivencia global.