CORRESPONDENCIA
Mª Isabel del Castillo Codes
Calle Rey Alí nº2 2C 23007 Jaén
Teléfono fijo: 953961396
Teléfono móvil: 653195255
israelcarrion@yahoo.es
Introducción
La pancreatitis aguda es un proceso inflamatorio del páncreas con afectación variable de los tejidos peripancreáticos que puede afectar a otros órganos. Su gravedad es variable y fue definida en el Simposio Internacional de Atlanta en el año 1992. Un 80 a 85% de los episodios son leves, con mínima o nula disfunción orgánica y presentan una recuperación espontánea. Sin embargo, el 15-20% restante son graves, con desarrollo de fallo orgánico o complicaciones locales (como son necrosis, absceso o pseudoquiste)[1], [2].
Con respecto a la fisiopatología de esta enfermedad, el paso inicial se cree que consiste en la activación del tripsinógeno en tripsina dentro de las células acinares[1], [3], [4]. La tripsina a su vez activa a otras proenzimas como la elastasa, la fosfolipasa A2 y la carboxipeptidasa, cuya acción dentro del propio páncreas provoca daño celular con edema y en ocasiones necrosis pancreática[3].
Asimismo, otros mecanismos que contribuyen el daño pancreático podrían ser el estrés oxidativo, alteraciones en la microcirculación del páncreas, liberación de citocinas y activación de células inflamatorias[5].
Se ha postulado la importancia de la respuesta al estrés del retículo endoplásmico y un desequilibrio en el balance proteasa-antiproteasa como eventos iniciadores de una pancreatitis aguda, que producen una importante activación del tripsinógeno[4], [6].
La pancreatitis aguda tiene una incidencia en España que oscila entre 30-50 casos por 100000 habitantes-año[7]. Constituye una de las causas más frecuentes de dolor abdominal agudo de consulta urgente. Afecta sobre todo a mujeres de mediana edad.
En cuanto a la etiología, la litiasis biliar y el alcohol constituyen las entidades más frecuentes de una larga lista de posibles causas.
Ante un episodio de pancreatitis aguda el objetivo principal debe ser detectar forma precoz los pacientes que evolucionarán a pancreatitis aguda grave, para poder aplicar desde el principio un tratamiento intensivo ya que, aunque la mayoría de los episodios son leves, un pequeño porcentaje sigue un curso desfavorable con la aparición de complicaciones y muerte.
Para ello, es necesario un sistema de predicción precoz de gravedad que posea elevada sensibilidad y valor predictivo positivo, que sea precoz para detectar necrosis (primeras 48 horas), rápido de realizar (disponible en urgencias), barato e independiente del observador.
Un sistema de gravedad basado exclusivamente en criterios clínicos no es eficaz, ya que a menudo es tardío, poco específico y depende de la agudeza clínica del observador.
Con respecto a los criterios bioquímicos, en primer lugar tenemos los parámetros de bioquímica general, que suelen alterarse en las pancreatitis graves de forma más evidente como es el caso del calcio, glucosa, leucocitos, urea, oxígeno y albúmina. Ninguno de ellos constituye por sí solo un buen predictor precoz de gravedad.
A continuación se han descrito numerosos sistemas pronósticos que combinan datos clínicos y bioquímicos, entre los que destacan el sistema de Ranson, extensamente utilizado, Glasgow, Imrie, Blamey y APACHE-II.
Todos ellos comparten el inconveniente de poseer escasa sensibilidad y especificidad, ser tardíos en la valoración precoz de la gravedad, a excepción de APACHE, que permite evaluación desde el ingreso, pero es un sistema muy complejo de realizar ya que consta de numerosos parámetros en su valoración.
Durante los últimos años se ha buscado un marcador único de gravedad, una sustancia cuya presencia en sangre u orina se asocie precozmente a la pancreatitis aguda grave y sólo a ella. Numerosos marcadores han sido propuestos para tal fin, entre los que figuran: proteína C reactiva, alfa-1-antitripsina, interleucinas, TNF-alfa, elastasa, procalcitonina, etc[8], [9].
Los marcadores de necrosis y activación de enzimas pancreáticas son una serie de variables que miden la activación del tripsinógeno, de las que destacan la alfa-2-macroglobulina, metahemálbumina, ribonucleasa pancreática, péptido activador del tripsinógeno urinario y péptido activador de la carboxipeptidasa, entre otros.
Con respecto a la alfa-1-antitripsina, su función es la inactivación en sangre de la tripsina activada
Para un punto de corte de 4.5 g/l se estableció una sensibilidad del 83% en la detección de necrosis[10]. También se ha observado que niveles superiores a 275 mg% al ingreso discrimina pacientes con buen y mal pronóstico (S = 71%, E = 85%)[11].
Existe un acentuado incremento de alfa 1 antitripsina en pancreatitis agudas graves, sin embargo algunos autores no encuentran relación estadísticamente significativa entre los niveles de alfa 1 antitripsina y la evolución clínica[12].
La alfa-2-macroglobulina, incluida en el grupo de marcadores de activación enzimática, es una antiproteasa que se une de forma irreversible a enzimas proteolíticos activados. Se han observado niveles séricos disminuidos de manera gradual desde el ingreso en pancreatitis graves, con significación a las 48 horas de evolución[13]. Sin embargo es un marcador cuya medición es cara y no aporta ventajas respecto a la proteína C reactiva.
La TAC abdominal constituye la exploración radiológica de elección en la valoración de la gravedad de la pancreatitis aguda, ya que además de las colecciones líquidas, nos permite conocer la presencia de necrosis pancreática y otras complicaciones como absceso y pseudoquiste. Permite además la realización de aspiración y drenaje percutáneo.
En el año 1985, Balthazar creó un sistema pronóstico de gravedad basado en hallazgos de TAC, con una serie de grados que van desde la normalidad del páncreas hasta cambios que afectan al páncreas y zonas adyacentes. Cada uno de estos grados se corresponde con una puntuación[14].
A continuación estableció una correlación entre el grado de gravedad en la TAC con la evolución clínica. Así, pacientes con grados A, B y C presentaban una mortalidad del 0% y morbilidad del 4%, mientras que los grados D y E se asocian con aumento considerable tanto de morbilidad como mortalidad.
La principal limitación de esta clasificación es que al no realizarse con contraste intravenoso no es posible detectar la presencia de necrosis. Por ello, en 1990 surge el sistema de Balthazar modificado o índice de gravedad por TAC, el cual, a la puntuación obtenida en el Balthazar clásico se le suma la presencia de necrosis. Dicha necrosis se cuantifica en función de la extensión, de manera que a necrosis menor del 30% le corresponden 2 puntos, entre 30 y 50, 4 puntos y 6 puntos para necrosis mayor del 50% del parénquima pancreático[15].
La resonancia magnética cada vez adquiere mayor protagonismo en la valoración de la pancreatitis aguda. Es una opción útil en pacientes alérgicos al contraste y no conlleva el riesgo de exposición a radiaciones ionizantes. Presenta una eficacia similar a la TAC en la detección de necrosis y es superior a ésta en la diferenciación entre necrosis focal y colección líquida perinecrótica. Informa sobre la constitución interna de masas inflamatorias así como de la integridad/disrupción del conducto pancreático principal. Permite detectar la presencia de colelitiasis. Es una exploración más cara y menos disponible que la TAC.
Recientemente es objeto de estudio el papel de la ecoendoscopia en la predicción precoz de la gravedad de la pancreatitis aguda, observándose en el estudio de Cho et al, una asociación entre el hallazgo de áreas hiperecoicas en el parénquima pancreático y formas graves[16].
Objetivo
Crear un sistema pronóstico de gravedad de pancreatitis aguda que englobe los criterios bioquímicos, criterios únicos y hallazgos de la TAC.
Pacientes y métodos
Hemos realizado un estudio prospectivo de cohortes de pacientes atendidos con cuadro de pancreatitis aguda por el Servicio de Aparato Digestivo del Complejo Hospitalario de Jaén durante los periodos comprendidos del 1 de octubre de 2009 a 30 de septiembre de 2011.
La población elegible la forman los pacientes con diagnóstico de pancreatitis aguda que cumplen los siguientes criterios de inclusión:
La presencia de dolor epigástrico irradiado a espalda y ambos hipocondrios
Niveles de amilasa superiores a 300 UI/l
Signos de inflamación pancreática en ecografía o en TAC
Se excluyeron los pacientes en los que se daban cualquiera de las dos condiciones siguientes:
La población de estudio quedó configurada por los pacientes consecutivos que cumplían los criterios de inclusión durante el periodo de estudio.
Dispusimos de tres fuentes de datos: una historia clínica detallada, la analítica, realizada en urgencias y a las 24-48 horas y radiografías simples (de tórax y abdomen) en urgencias así como ecografía y TAC abdominal en las primeras 72 horas, realizados una vez que el paciente fue informado y firmara el consentimiento.
Después, los episodios se clasificaron en leves o graves según los criterios de Atlanta y desde un punto de vista etiológico en pancreatitis litiásica, etílica o idiopática.
Análisis estadístico:
Los datos se introdujeron en un protocolo diseñado con epiinfo 6.04. Desde este programa se exportaron para ser procesados mediante el programa stata 8/se. Los datos se depuraron para disminuir los errores cometidos durante su introducción. Una vez depurada la información se procedió al análisis estadístico.
En el procedimiento seguido para la elaboración de la escala hemos usado la regresión logística con las siguientes etapas:
Elección del índice de Balthazar que mejor predice gravedad (clásico o Balthazar I versus modificado o Balthazar II).
Determinación de los predictores independientes de gravedad sin Balthazar.
Determinación de los predictores que añaden información al Balthazar seleccionado antes.
Adición independiente de cada predictor al índice Balthazar seleccionado.
Se seleccionó el predictor más significativo y se repitió el proceso.
Se configuró una escala para ser usada de forma simple en la clínica mediante el redondeo y simplificación de los coeficientes de los modelos de regresión logística multivariable. En todas estas situaciones se realizó una curva ROC y se estimó el área bajo la curva.
Resultados
La población de estudio (Tabla 1) queda constituida por 203 pacientes con pancreatitis aguda, 122 varones y 81 mujeres, con una edad media de 58 años y desviación estándar de ± 18 años. 104 episodios fueron leves y 99 graves. En cuanto a la etiología, la más frecuente fue la litiásica (96 pacientes), seguida de la idiopática (57) y en tercer lugar la etílica (43).
Tabla 1
Tabla 1. Descripción de la población total.
Tabla 2
Nuestro objetivo es elaborar una escala pronóstica de pancreatitis aguda en la que, además de Balthazar, figuren criterios analíticos.
En primer lugar, hemos realizado un análisis de regresión logística para ver cuál de los dos índices de Balthazar predice mejor la gravedad. Para ello se optó por un análisis de residuales. Se hizo una regresión lineal entre los dos índices de Balthazar, utilizando el II como variable dependiente y la recta de regresión que se obtuvo fue:
Balthazar II= -0.6561208 + 2.140922* Balthazar I
El r2 de este modelo fue 0.843, lo que significa que el Balthazar I determina un 84.3% de la variabilidad del II.
Con la información dada por la recta de regresión se calculan los residuales del Balthazar II no predicho por el I:
Residuales del BII =Balthazar II +0.6561208- 2.140922*Balthazar I.
Los residuales del Balthazar II se introdujeron en un modelo de regresión logística junto a Balthazar I y los resultados se muestran en la tabla 2 Los residuales de Balthazar II no añaden capacidad predictiva a Balthazar I de forma significativa. El proceso se invirtió y se utilizó como variable dependiente al Balthazar I y como independiente al Balthazar II. La recta de regresión dio los valores:
Tabla 3
Tabla 2. Modelo de regresión logística de Balthazar I con los residuales de Balthazar II.
|
|
Odds ratio |
IC 95% |
P |
|
Balthazar I |
35.45 |
8.24-152.38 |
< 0.001 |
|
ResBalthazar II |
2.08 |
0.96-4.52 |
0.062 |
Balthazar I= 0.5637446 + 0.3941722* Balthazar II
Luego se calcularon los residuales del Balthazar I con los valores predichos del Balthazar I por el Balthazar II. Los residuales del Balthazar I constituyen la parte del Balthazar I que no está predicha por el II. Se incluyeron los residuales del Balthazar I con el Balthazar II en un modelo de regresión logística (Tabla 3). A diferencia del anterior modelo, los residuales del Balthazar I sí añaden información al Balthazar II. La interpretación conjunta de los análisis anteriores indica que el Balthazar I es mejor predictor y que el Balthazar II no añade información significativa a la proporcionada por el Balthazar I.
Tabla 4
Tabla 3. Modelo de regresión logística de Balthazar II con los residuales de Balthazar I.
|
|
Odds ratio |
IC 95% |
P |
|
Balthazar II |
4.57 |
2.38-8.80 |
< 0.001 |
|
ResBalthazar I |
7.32 |
1.79-29.91 |
0.006 |
Tabla 5
Tabla 4. Modelo de regresión con las tres variables significativas.
|
|
Odds ratio |
IC 95% |
P |
|
Balthazar I |
54.13 |
7.91-370.22 |
< 0.001 |
|
Alfa-1-antitripsina (g/l) |
27.16 |
2.25-326.60 |
0.009 |
|
Urea 24 horas (mg/dl) |
1.05 |
1.01-1.09 |
0.007 |
Tabla 6
Tabla 5. Modelo de regresión según puntos de corte.
|
|
Odds ratio |
IC 95% |
P |
|
Balthazar I |
46.00 |
8.82-239.80 |
< 0.001 |
|
Alfa-1-antitripsina-C-2.5 (g/l) |
36.63 |
2.80-479.26 |
0.006 |
|
Urea 24 horas-C-60 (mg/dl) |
21.28 |
1.10-408.90 |
0.043 |
En segundo lugar hemos realizado un análisis para determinar las variables que de manera independiente influyen en la gravedad, en ausencia de Balthazar.
Ello se ha hecho mediante un análisis de regresión logística escalonado hacia delante teniendo en cuenta las variables con pérdidas sustanciales. Las variables seleccionadas se forzaron en el modelo y estos son los resultados: neutrófilos 24 horas, sodio, amilasa y alfa 1 antitripsina quedan como variables candidatas a añadir información predictiva al Balthazar I.
Cuando a este modelo le añadimos el Balthazar I resulta que sólo la alfa-1-antitripsina añade información, quedando por lo tanto como 2ª variable junto con Balthazar I en nuestra escala pronóstica.
Por lo tanto, ahora partimos de un modelo con 3 variables, en las que 2 de ellas son siempre Balthazar I y alfa -1- antitripsina y cada vez se va añadiendo otra variable.
Con las variables que salen significativas se realiza un modelo saturado que revienta por un problema muy grave de colinealidad.
Entonces eliminamos variables que interaccionan entre sí y se repite el modelo.
Resulta que la candidata a ser la 3ª variable de la escala es la urea 24 horas.
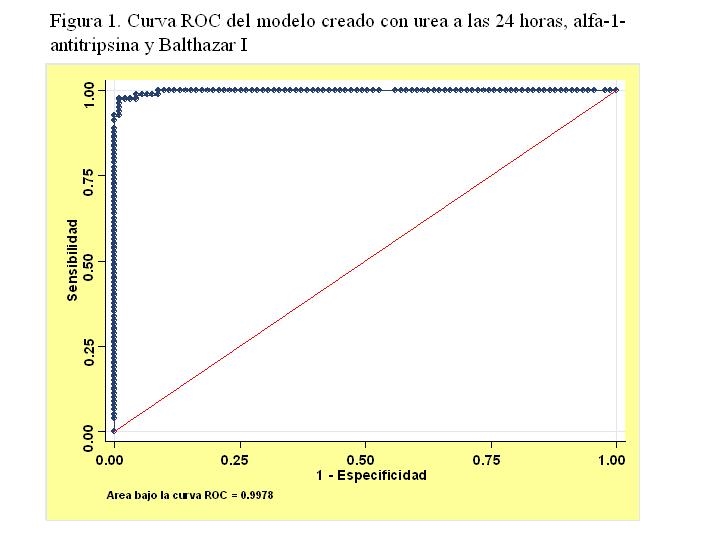
Obtenemos así un modelo final con las 3 variables: Balthazar I, alfa-1-antitripsina y urea a las 24 horas y su curva ROC correspondiente con un área bajo la curva de 0.9978 (Figura 1).
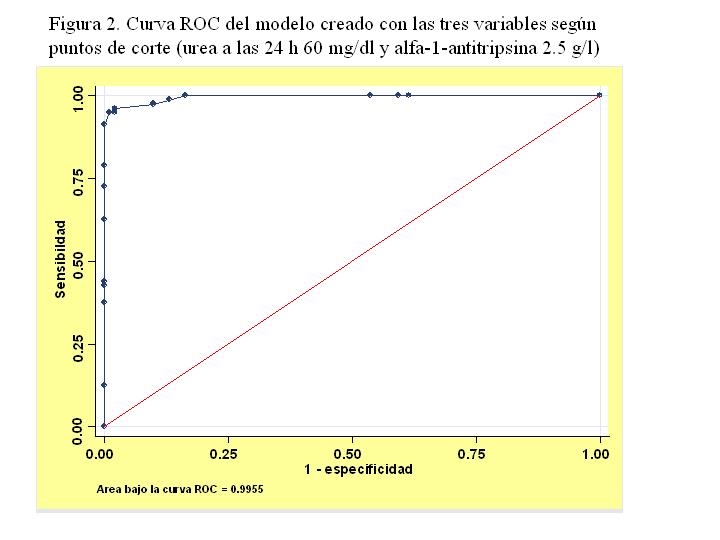
Los modelos con variables continuas son difíciles de implementar en la práctica. Por ello se utilizaron puntos de corte. Se utilizó una aproximación heurística y los puntos seleccionados para la alfa 1 antitripsina fue 2.5 y para la urea 24 horas de 60. Se repitió el modelo de regresión logística y se obtuvo un área bajo la curva ROC de 0.955 (Figura 2).
Figura 2
Curva ROC del modelo creado con las tres variables según puntos de corte (urea a las 24 horas 60 mg/dl y alfa-1 antitripsina 2.5 g/l).
Después se procede a operativizar el modelo para facilitar su manejo en la clínica. Para ello se crean tres escalas con las tres variables del modelo:
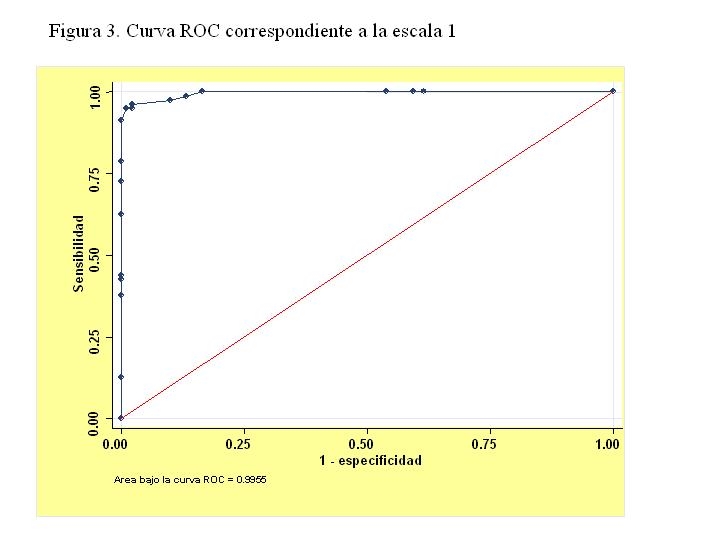
Escala 1: Esta escala 1 se basa en el redondeo de los coeficientes de logístico de 46 a 45 en Balthazar I, de 36 a 35 en la alfa-1-antitripsina y de 21 a 20. El máximo común divisor para obtener enteros es 5. Se simplifican los coeficientes dividiéndolos por 5 y resultan 9 puntos por cada nivel de Balthazar I (partiendo de 0), 7 si la alfa-1-antitripsina >2.5 g/l y 4 si la urea 24 horas > 60 mg/dl. En la figura 3 se muestra la curva correspondiente a esta escala.
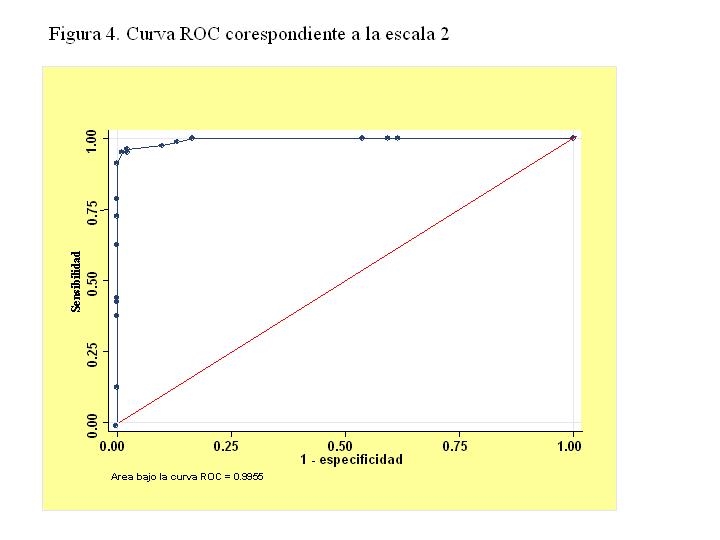
Escala 2: Esta escala 2 se basa en el redondeo de los coeficientes de logístico de 46 a 50 en Balthazar I, de 36 a 40 en la alfa-1-antitripsina y de 21 a 20. El máximo común divisor para obtener enteros es 10. Se simplifican los coeficientes dividiéndolos por 10 y resultan 5 puntos por cada nivel de Balthazar I (partiendo de 0), 4 si la alfa-1-antitripsina >2.5 g/l y 2 si la urea 24 horas > 60 mg/dl. En la figura 4 se muestra la curva correspondiente a esta escala.
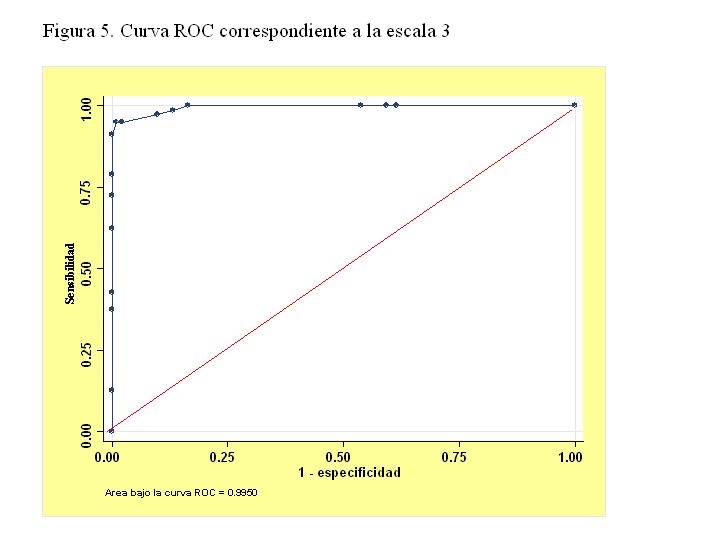
Escala 3: Esta escala 3 se basa en el redondeo de la escala 2, si se divide por 2 los valores de la escala 2 resultan 2.5 puntos por cada nivel de Balthazar I (partiendo de 0) y éste se redondea a 3, 2 si la alfa-1-antitripsina >2.5 g/l y 1 si la urea 24 horas > 60 mg/dl. En la figura 5 se muestra la curva correspondiente a esta escala.
Finalmente se compararon las curvas ROC de las escalas. Entre la escala 1 y la escala 2 no existen diferencias significativas. Tampoco existen entre la escala 1 y la escala 3 (p = 0.3476). Al comparar la escala 2 con la escala 3 se obtiene una p de 0.3476.
Discusión
En la mayoría de los casos, la pancreatitis aguda es una enfermedad leve y autolimitada con una recuperación del paciente sin incidentes y una mortalidad menor del 2%[17].
Resulta llamativo que en nuestro grupo de pacientes el sistema de Balthazar clásico sea más útil que el modificado, donde se incluye como nuevo criterio de gravedad la presencia y extensión de necrosis. Una explicación para estos hallazgos es que tal vez la gravedad sobrevenga de la infección de la necrosis[18] y no sólo de la presencia de la misma, y es esta infección la que provoca el fallo multiorgánico[19] y el desarrollo de complicaciones sistémicas[20]. Bollen et al en 2011 realizaron un estudio en el que compararon ambos índices en la valoración de la gravedad de las pancreatitis agudas, sin encontrar diferencias significativas entre ambos[21].
A lo largo de los años, múltiples autores han ido creando variados sistemas pronósticos más o menos complicados, todos con la pretensión de obtener la mayor sensibilidad y especificidad posible para la detección precoz de una pancreatitis grave[22-24]. Sin duda, los criterios de Ranson han sido y son los más utilizados en las urgencias de los hospitales a pesar de que sistemas posteriores han demostrado igual o mayor eficacia. La irrupción de las imágenes en la patología pancreática comenzaron a sustituir a la analítica, pero, como siempre, la virtud se encuentra en el término medio y probablemente el futuro se encuentre en el hallazgo de un sistema que englobe los criterios clínicos, bioquímicos y de imagen en un sistema sencillo, que sea fácil de recordar y que pueda ser utilizado de forma universal.
Tras realizar un exhaustivo estudio estadístico se encuentra en nuestros datos que, entre los criterios bioquímicos generales, el parámetro que más aporta a aumentar la potencia del sistema es la urea determinada a las 24 horas del ingreso. La urea es utilizada por otros autores en sistemas complejos, como los criterios de Hong-Kong[25], aunque usaban las cifras al ingreso, en los criterios de gravedad de Blamey[26], de Imrie[27], el sistema de Glasgow[28]. que los valoran dentro de las primeras 24 horas del ingreso, y se coincide plenamente con los hallazgos de Ranson y otros, los cuales también valoran el aumento de urea a las 48 horas[29]. La urea al ingreso se relaciona con el estado renal preexistente y con el grado de deshidratación previo al tratamiento médico, por lo que parece más correcto el uso de este valor una vez pasadas las primeras horas y corregidas estas variables que puedan influir en la valoración de la gravedad, tal y como se ha mostrado estadísticamente en nuestro grupo de pacientes.
En cuanto a los parámetros de inflamación, se encuentra que la alfa-1-antitripsina era la que más aportaba al sistema con valores por encima de 2.5g/l. La alfa-1 antitripsina tiene como función, junto a la alfa-2 macroglobulina, la inactivación en sangre de la tripsina activada, con elevada fiabilidad para la detección de necrosis[10]. No existen muchos estudios en la bibliografía sobre este parámetro, siendo el más interesante el trabajo de De la Peña et al[11], en el que se encontraban una aceptable sensibilidad y especificidad, con una buena correlación con el índice de Ranson en el ingreso, pero no a las 48 horas.
En lo que respecta a los hallazgos de imagen, ya se ha insistido en el hallazgo en nuestro grupo de pacientes de la mayor utilidad del inicial sistema de Balthazar con mayor utilidad que la modificación posterior.
En conjunto se ha obtenido una escala con un área bajo curva ROC de 0.9955, con lo que se podría concluir que es un sistema extremadamente útil para detectar la gravedad en nuestro grupo de pacientes, muy difícil de superar.
En la práctica diaria de nuestro hospital resulta fácil utilizar la urea y los hallazgos de la TAC en las primeras 48 horas, ya que están al alcance de cualquier médico en los hospitales de cualquier nivel. La adición de un parámetro inflamatorio a este sistema resulta más complicada. En nuestro servicio hemos utilizado la alfa-1 antitripsina al haber demostrado ser el de mayor utilidad en nuestra población, pero, probablemente, no sea imprescindible el uso de esta enzima en concreto, sino que parece más lógico que cada hospital utilice el parámetro que le resulte más cómodo en su práctica diaria (PCR, elastasa, interleucinas, procalcitonina, etc.). Lo que sí hemos mostrado de forma sugestiva es que con el uso de un sistema que englobe los tres grandes grupos de criterios de gravedad (bioquímicos, criterios únicos y de imagen), la posibilidad de predecir que una pancreatitis pueda ser grave es máxima y difícil de superar con el uso de estos criterios por separado.