CORRESPONDENCIA
Silvia Gómez Senent
Servicio de Aparato Digestivo. Hospital Universitario La Paz.
Paseo de la Castellana 261. 28046 Madrid.
silviagsenent@gmail.com
Introducción
El intestino es un tubo hueco con cuatro capas concéntricas. Desde la luz al exterior se disponen las capas[1]: 1) mucosa, que está formada por una cubierta epitelial, tejido conectivo laxo o lámina propia, y muscularis mucosa. 2) submucosa, 3) muscularis propia, con una capa circular interna y otra de fibras longitudinales, y 4) serosa o adventicia. Estas capas histológicas se corresponden con su aspecto ecográfico que se conoce como la marca intestinal y se pueden visualizar hasta cinco capas. Las capas ecográficas aparecen de forma alternativa: ecogénicas e hipoecoicas; la primera, tercera y quinta capas con ecogénicas y la segunda y cuarta hipoecoicas. Esta relación de capas histológicas con las capas de la ecografía es fácil de recordar a partir de la identificación de los componentes musculares de la pared intestinal (la muscularis mucosa y muscularis popia) que son capas hipoecoicas en la ecografía (tabla 1).
Tabla 1
Signos ecográficos en la EC.
En la ecografía de rutina, la marca intestinal puede variar desde un "ojo de toro" en sección transversal, con una zona central ecogénica y un borde hipoecoico, hasta la representación completa de las cinco capas ecográficas. La pared intestinal normal es uniforme y elástica, con un promedio de grosor de 3 mm si está distendido y de 5 mm si no lo está.
Patología de la pared intestinal
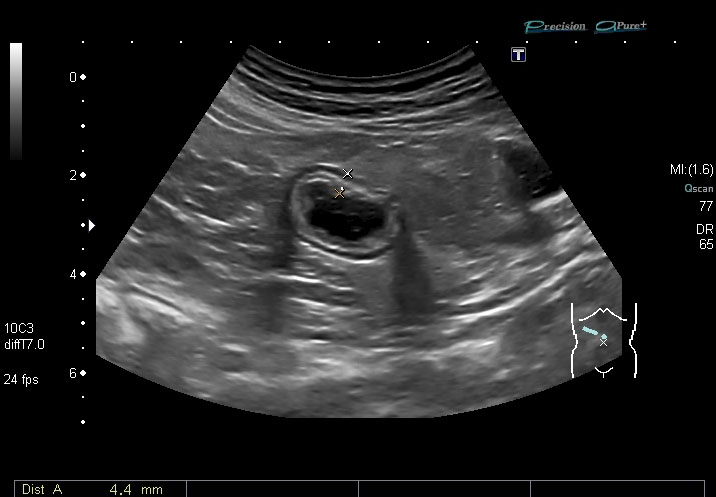
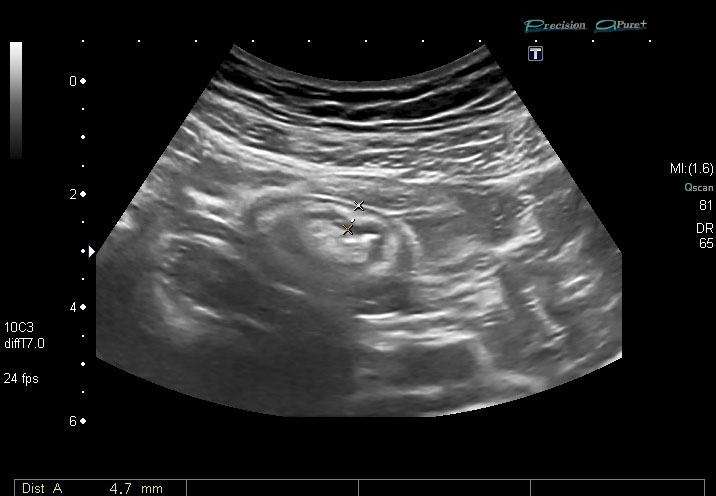
La patología de pared intestinal determina que existan patrones ecográficos característicos. El más familiar, el patrón en diana (Figura 1), fue descrito por primera vez por Lutz y Petzoldt[2] en 1976 y posteriormente por Bluth y cols[3], que lo describieron como un patrón de "pseudorriñón" (Figura 2), resaltando que representaban una lesión patológicamente importante en más del 90% de los pacientes con este patrón. En ambas descripciones el borde hipoecoico externo se correlaciona con la pared engrosada del intestino, mientras que el centro ecogénico se relaciona con la luz residual del intestino o ulceraciones mucosas. La diana y el pseudorriñón son los equivalentes anormales de la marca intestinal derivados de un intestino normal.
La identificación de un intestino engrosado en la ecografía puede relacionarse con distintas patologías. Las posibilidades diagnósticas se pueden deducir determinando: 1) extensión y ubicación de la patología, 2) conservación o destrucción de las capas de la pared, y 3) afectación concéntrica o excéntrica de la pared. EL carácter benigno lo favorece una afectación segmentaria extensa con engrosamiento concéntrico y con la conservación de las capas de la pared. La patología benigna clásica que muestra un engrosamiento de la pared intestinal es la EC. El carácter maligno será más probable en afectaciones de segmentos más cortos con enfermedad excéntrica y destrucción de las capas de la pared. La patología maligna más típica es el adenocarcinoma.
El uso de la ecografía en los pacientes con EC y colitis ulcerosa (CU) se ha utilizado tanto para su diagnóstico como para evaluar la extensión, el grado de actividad inflamatoria e intentar hacer un diagnóstico diferencial de ambas entidades.
La CU es una inflamación de la mucosa del colon que muestra mínimos cambios ecográficos, en cambio, la EC, es una enfermedad inflamatoria granulomatosa crónica transmural que afecta a todas las capas de la pared intestinal, caracterizada por múltiples episodios de exacerbación y remisión.La localización más frecuente es el ileon terminal (20%), el colon (30%) y la región ileocecal (50%).
La ecografía supone una técnica no invasiva para la caracterización de los cambios parietales y extraparietales del intestino siendo, en manos expertas, de gran sensibilidad como investigación primaria en pacientes con EC sintomática. La ecografía se considera una buena técnica inicial en la sospecha de EC (sensibilidad de 88-95%, especificidad 98-100%). El estudio basal determina la extensión y actividad de la enfermedad evaluando los signos clásicos de la EC: engrosamiento de la pared del tubo digestivo, infiltración grasa, hiperemia, linfadenopatía mesentérica, estenosis y alteraciones de la mucosa. La ecografía también predice las complicaciones: masas inflamatorias (flemón o absceso), fístulas, obstrucción, perforación y apendicitis. Además la ecografía detecta las recidivas postoperatorias e identifica a los pacientes que precisan técnicas más invasivas. La exposición de radiación es importante en la población joven con la EC, por este motivo la ecografía debe ser una técnica de rutina en pacientes con esta patología (tabla 1).
Signos clásicos
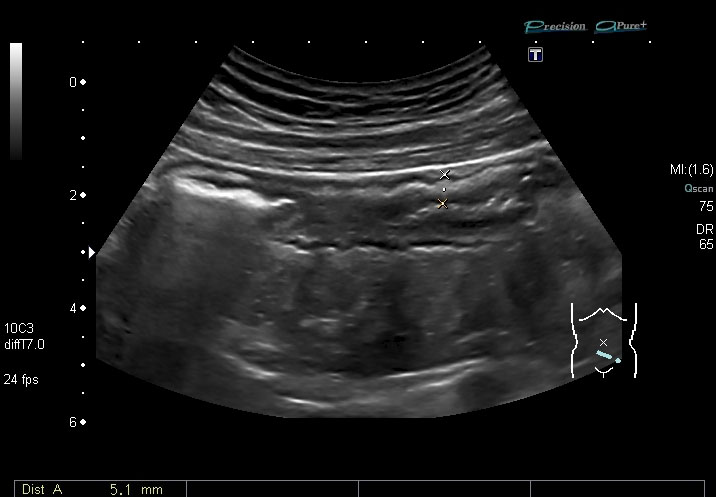
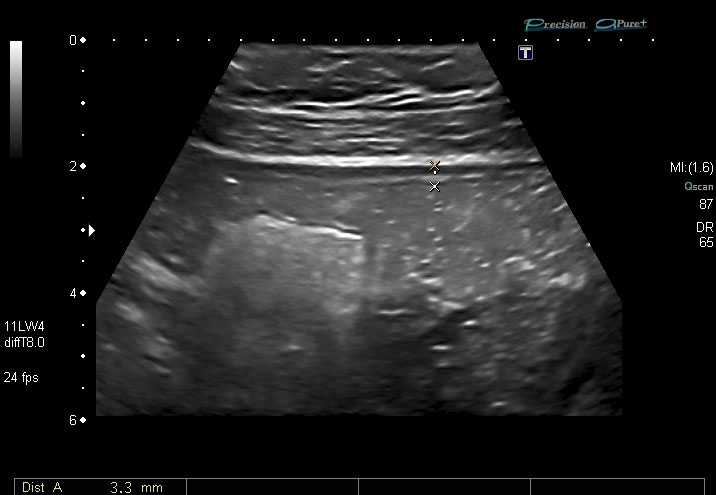
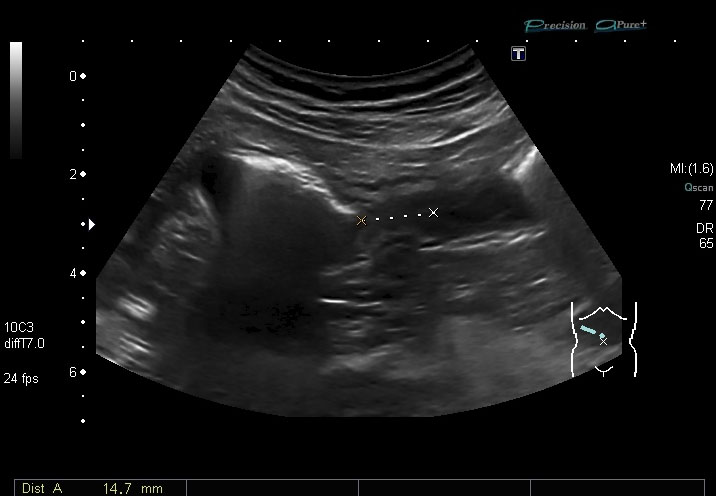
Engrosamiento de la pared del tubo digestivo: en un metaanálisis sobre la precisión de la ecografía para detecta la EC, Fraquelli y cols[4] mostraron una sensibilidad del 88% y una especificidad del 93%, cuando el umbral para el engrosamiento de la pared intestinal se estableció en 3 mm, y del 75% y 97% , respectivamente, para un umbral mayor de 4 mm (Figuras 3 y 4). Por tanto , el signo en el que nos basamos para decir que un segmento intestinal está afectado en la EC es un engrosamiento de la pared de más de 3 mm, con luz conservada o colapsada, con disminución o ausencia del peristaltismo. En una revisión sistemática reciente[5], la sensibilidad global por paciente de la ecografía en el diagnóstico de la EC fue del 85% (IC del 95% 83-87%. La especificidad global por paciente basada en los estudios en los que se observó era del 98% (IC del 95% 95-99%).Cuando el engrosamiento de la pared es entre 5-15 mm, se considera moderado, acompañándose de rigidez del asa afectada.
La ecogenicidad de la pared varía en función del grado de infiltración inflamatoria y fibrosis. Es habitual la estratificación con las capas del intestino conservadas. Es posible un aspecto en diana o de pseudorriñon en la enfermedad aguda o enfermedad fibrótica de larga evolución cuando las capas de la pared intestinal se van perdiendo. La enfermedad de larga evolución, y con frecuencia terminal, puede mostrar también sutiles cambios en el engrosamiento de la pared con depósito de grasa en la submucosa, que muestra una ecogenicidad aumentada (Figura 5).
El intestino afectado de forma activa parece rígido y fijo, con disminución o ausencia de peristaltismo. La angulación suele estar presente y destacan también las imágenes de saculación del borde antimesentérico. De acuerdo con la literatura, el engrosamiento de la pared intestinal se detecta ecográficamente en un 22-89% de los casos. Esta variación refleja diferencias de la técnica ecográfica, del equipo de ultrasonidos y de la experiencia del explorador.
Infiltración grasa: la infiltración transmural[6] de la EC causa edema y fibrosis en el mesenterio adyacente. Son características las improntas digitiformes de la grasa mesentérica. Por ecografía, la creeping grasa aparece como un "efecto masa" hiperecoico y uniforme (Figura 6). La infiltración grasa es la causa más frecuente de separación del asa intestinal y se detecta en los estudios gastrointestinales con contraste. También es la alteración más llamativa y evidente en la ecografía de pacientes con procesos inflamatorios perientéricos, por ello, la detección de infiltración grasa debe llevar a una evaluación minuciosa del intestino regional.
Linfadenopatías: cuando la EC está en fase activa pueden aparecer ganglios hipertrofiados. Los ganglios se muestran como masas hipoecoicas focales, redondeadas, rodeando al intestino en la localización que corresponde a la fijación mesentérica. Los ganglios mayores de 3 cm de diámetro, sugieren una complicación maligna de la EC.
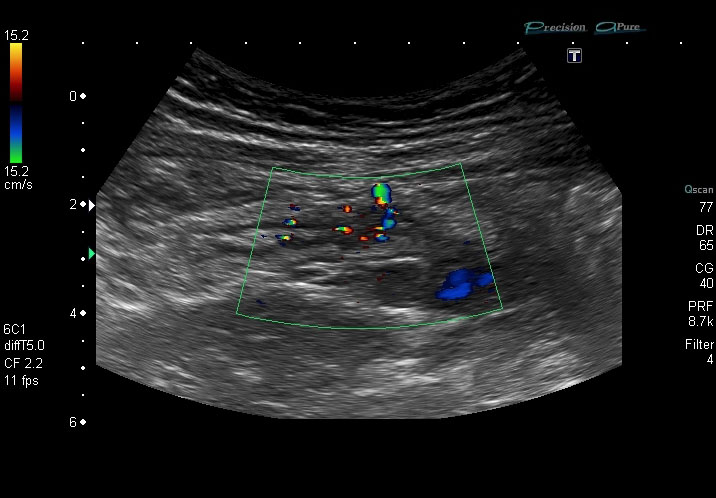
Hiperemia: la evaluación del flujo sanguíneo es útil para monitorizar la actividad inflamatoria y la respuesta al tratamiento. Estudios histológicos han demostrado que un cambio histológico precoz en pacientes con EC activa es la presencia de neovascularización en la pared intestinal (Figura 7). El Doppler color permite ver la neovascularización, que comentábamos anteriormente, tanto en la pared del asa afecta como en el flujo de los vasos intestinales principales (AMS y AMI). Sin embargo, según los estudios histológicos mencionados previamente, también hay una proliferación de microvasos en la pared intestinal de los segmentos inflamados, en concreto en la lámina propia y en la submucosa, Con el Doppler color sólo valoramos la presencia de vasos macroscópicos, mientras que con la utilización de los contrastes se segunda generación también se puede valorar la microvascularización. Van Oostayen y cols.[7] mostraron que las mediciones del flujo sanguíneo en la arteria mesentérica superior se correlacionaba con la actividad de la enfermedad: los valores de flujo eran significativamente más elevados en 15 pacientes con enfermedad activa respecto a 14 pacientes sin enfermedad activa (p<0,05). Más recientemente Serra y cols.[8] demostraron que la ecografía con contraste (CEUS), realizada con un medio de contraste de burbuja de segunda generación, era una técnica más sensible y reproductible que el Doppler. El CEUS permite tanto evaluaciones cualitativas como cuantitativas de la hiperemia de la pared intestinal al observar el patrón de realce.
Estenosis: las estenosis se relacionan con el estrechamiento del intestino. Las superficies luminales de los segmentos afectados casis siempre se muestran con una posición fija y constante, con la luz en forma de área central con una ecogenicidad lineal dentro del asa intestinal engrosada (Figura 8).
Alteraciones mucosas: resulta difícil evaluar por ecografía fisuras y pequeñas úlceras lineales, que se presentan como líneas ecogénicas.
Complicaciones
La utilidad más contrastada de la ecografía en la literatura es la detección de complicaciones que ocurren en aproximadamente el 50-70% de los pacientes en algún momento de la enfermedad. Un hallazgo característico es la presencia de extensión transmural de la enfermedad, ocurriendo en un tercio de los pacientes.
Masas inflamatorias: un flemón se manifiesta como una masa hipoecogénica de bordes irregulares, donde no es posible identificar la pared intestinal por licuefacción. Por el contrario, un absceso aparece como una colección líquida con pared engrosada y con imágenes ecogénicas en su interior. Las masas inflamatorias se localizan a nivel mesentérico o alrededor de los distintos segmentos del intestino. Para la detección de abscesos la ecografía tiene una sensibilidad del 100% y una especificidad del 92%.
Formación de fístulas: esta típica complicación de la EC se produce casi siempre en el extremo proximal de un segmento engrosado y estenosado del intestino. Aunque es difícil evaluar las ulceraciones de la mucosa con la ecografía, las fisuras profundas del intestino se muestran como áreas ecogénicamente lineales que penetran en profundidad y sobrepasan el borde de la luz intestinal.
Con la formación de la fístula, se pueden apreciar bandas de ecogenicidad variable en los segmentos de intestino anormal hacia la piel, vejiga, vagina u otras asas intestinales. Si existe gas o movimiento en la fístula durante el estudio ecográfico, la fístula se mostrará habitualmente brillante o ecogénica. Por el contrario, si el recorrido de la fístula está vacío o parcialmente cerrado, la fístula se mostrará negra o hipoecoica.
Obstrucción: es una de las indicaciones más frecuentes de cirugía en pacientes con EC. La fibrosis producida, la estenosis, la angulación o la fijación de asas intestinales puede provocar obstrucción intestinal, que puede ser diagnosticada ecográficamente como asas intestinales dilatadas y con aumento de su peristaltismo en sentido proximal a la obstrucción. Para la detección de estenosis la ecografía tiene una sensibilidad del 100% y una especificidad del 91%.
Perforación: aunque la perforación intestinal libre es rara en la EC, es una complicación letal. Sí que es más frecuente una perforación localizada con masas flemonosas.
Apendicitis: la afectación apendicular de la EC se sitúa en torno a un 20% de pacientes sometidos a cirugía por ileocolitis granulomatosa. Pero la apendicitis también puede ser la manifestación inicial de una EC. Sólo un 10% de pacientes con una apendicitis de Crohn desarrollarán posteriormente una ileocolitis en lo siguientes 2 a 8 años. La imagen ecográfica de la apendicitis asociada EC es indistinguible de la apendicitis simple. Sugiere EC la inflamación concomitante del meso del íleon terminal y del ciego.
Utilidad del doppler color y ecografía contrastada en la EC
Evaluación de la actividad inflamatoria
Los vasos macroscópicos en la pared intestinal inflamada pueden evaluarse mediante el Doppler color. En el estudio de Spalinger et al[9] realizado en 95 pacientes se observaron diferencias significativas entre los pacientes en fase aguda y fase quiescente en el grado de vascularización. Considerando como activos los pacientes que ecográficamente tenían color moderado o intenso se obtuvo una sensibilidad muy alta (98%) y una moderada especificidad (69%) para detectar a los pacientes con enfermedad activa en el CDAI. En el estudio de Ripollés et al[10-12], la hiperemia es un hallazgo frecuente en pacientes con CDAI elevado (sensibilidad >93%), pero muchos pacientes asintomáticos también tienen hiperemia (poca especificidad-alrededor del 45%). Esto se puede deber a que las escalas de actividad se basan sobre todo en los síntomas del paciente, que no reflejan necesariamente lo mismo que las alteraciones ecográficas o los hallazgos endoscópicos o histológicos.
Existe más consenso en cuanto a la relación entre grado de hiperemia en Doppler color y actividad endoscópica o histológica. Por otra parte, se ha demostrado una correlación estadísticamente significativa entre el grado de flujo Doppler color y el grado de realce de la pared intestinal con resonancia magnética, ya que ambos parámetros evalúan la vascularización de la pared.
La actividad inflamatoria se puede valorar también con ecogafía Doppler de la arteria mesentérica superior (AMS) y la arteria mesentérica inferior (AMI), midiendo la velocidad o el flujo, basándose en que la neovascularización de la pared inflamada produce un aumento del flujo de las arterias y venas mesénticas.
Existen estudios que han encontrado relación significativa entre actividad inflamatoria medida con el CDAI y los parámetros Doppler de la AMS o de la AMI. En estos estudio, en los casos con enfermedad activa se observó tanto un incremento de la velocidad como del flujo, así como una disminución del índice de resistencia por aumento del flujo diastólico. Otros estudios, sin embargo, no han encontrado correlación con la actividad clínica. La ecografóa Doppler de los vasos mesentéricos es una exploración larga, difícil técnicamente, con una tasa de fracasos del 30-40%[13], [14].
En varios estudios se ha observado mayor correlación entre el CDAI y el realce del asa tras inyección de contraste que con el grado de hiperemia medida con Doppler color. En un trabajo reciente se observó que el patrón de realce de la pared del asa tras la inyección de contraste ecográfico permitía discriminar entre pacientes activos o inactivos según el CDAI. Considerando como activos los pacientes con realce abundante, observado como realce completo de la pared o realce de las capas internas (mucosa y submucosa), se obtuvo una sensibilidad y especificidad del 81% y 63% respectivamente para distinguir enfermedad activa de inactiva[8].
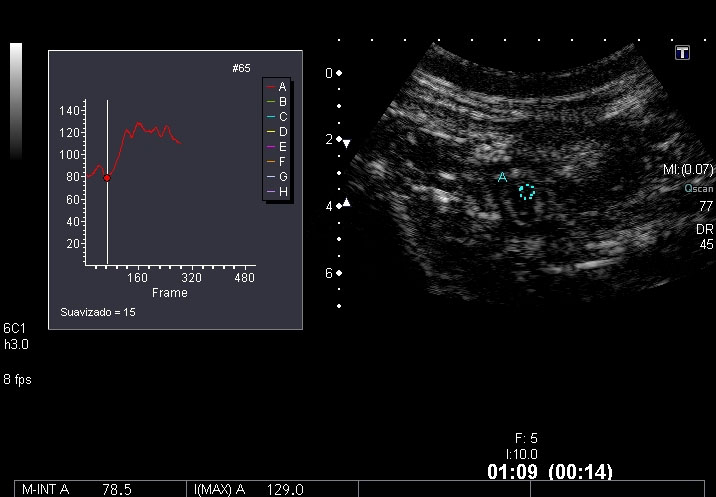
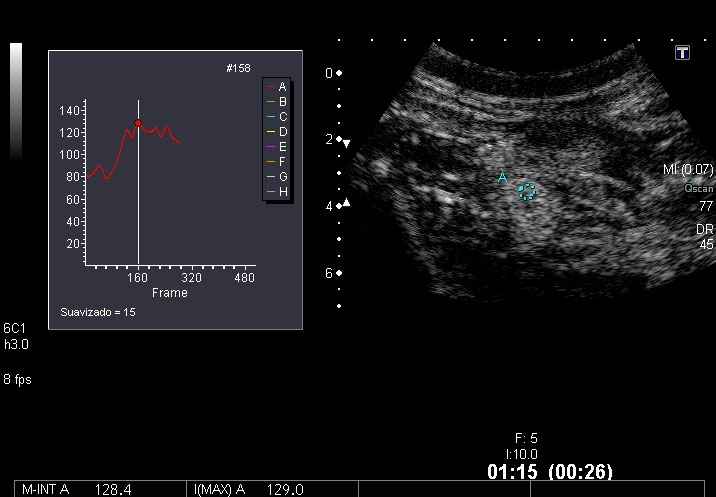
Las medidas cuantitativas del grado de realce de la pared intestinal mediante análisis de curvas brillo-tiempo son más objetivas (Figuras 9 y 10). Estas medidas se correlacionan significativamente con la actividad inflamatoria endoscópica. En un estudio de Ripollés et al[15], con 61 pacientes a los que se les había realizado endoscopia, la media del realce parietal de los pacientes con actividad endoscópica moderada o severa fue significativamente mayor que la media de los pacientes con actividad leve o ausente. Utilizando un valor de corte de incremento porcentual de realce del 46% se obtuvo una sensibilidad del 96% y una especificidad del 73% para detectar actividad endoscópica moderada o severa.
Monitorización del tratamiento
La principal aplicación clínica de la cuantificación de la actividad inflamatoria en la EC es monitorizar la respuesta al tratamiento, lo cual ayuda a dirigir la estrategia terapéutica. Se ha publicado que después de un tratamiento médico efectivo, la ecografía muestra reducción tanto en el grosor como en el grado de vascularización. Por tanto esto podría ser útil para monitorizar el tratamiento. Los cambios ecográficos son mucho más lentos que los cambios en el CDAI. Según Ripollés et al[12], con tratamientos convencionales estos cambios tienen moderada correlación con los cambios clínicos o analíticos, ya que objetivó en un estudio con 28 pacientes, que aunque el grado de vascularización se redujo significativamente después del tratamiento, no se encontró correlación con la reducción del CDAI. Pero donde fue más útil el Doppler color fue en el seguimiento de los pacientes, en el que se observó hiperemia persistente en el 76% de los pacientes que tuvieron recidivas o necesitaron cirugía durante el siguiente año, frente la 18% con buena evolución. Por tanto, la hiperemia persistente en la pared del asa afectada podría identificar pacientes con remisión incompleta desde el punto de vista histopatológico, con predisposición a recidivas a corto o medio plazo. Estos resultados podrían tener implicaciones en el tratamiento, ya que seleccionaría a pacientes con riesgo alto de recidiva, que podrían beneficiarse de tratamientos mas agresivos o más prolongados.
La introducción de los anti TNF en el tratamiento de la EC ha aumentado la tasa de respuesta clínica, con disminución del número de ingresos y de intervenciones quirúrgicas comparado con las terapias convencionales. A pesar de la efectividad de los anti TNF, se ha observado una elevada frecuencia de recidivas precoces tras suspender el tratamiento al alcanzar la remisión. Esto se debe a persistencia de actividad inflamatoria en algunos casos con buena respuesta clínica.
Valoración de estenosis
Ante una obstrucción es importante diferenciar entre estenosis inflamatoria o por fibrosis, ya que la primera responde al tratamiento médico y la segunda necesita cirugía. Cuando se trata de una estenosis inflamatoria, se observa hipervascularización, mientras que cuando son fibróticas son hipovasculares.
Diferenciación absceso-flemón
El Doppler nos ayuda a diferenciar flemones y abscesos, ya que los primeros muestran vascularización en su interior y los abscesos sólo en la periferia. La ecografía con contraste distingue ambas entidades, ya que los flemones, como masas inflamatorias, realzan mientras que los abscesos son avasculares.
Guía de consenso sobre técnicas de diagnóstico por imagen para la EC
En el 2013 salió publicada una guía de consenso[16], [17] sobre las técnicas de diagnóstico por imagen para la evaluación de la enfermedad inflamatoria intestinal, siendo los puntos más importantes en lo que se refiere a la ecografía abdominal los siguientes:
La ecografía es una técnica de diagnóstico por imagen bien tolerada y sin radiación, sobre todo para el íleon terminal y el colon. La presencia de gas en el intestino y un hábito corporal grande dificultan el examen.
La ecografía permite detectar signos de enfermedad de Crohn, con una exactitud diagnóstica alta .
La ecografía puede emplearse para evaluar la actividad de la enfermedad en la enfermedad de Crohn ileal terminal.
Tiene una alta sensibilidad y especificidad en el diagnóstico de las estenosis que afectan al intestino delgado.
Esta técnica puede ser muy exacta en la evaluación de complicaciones penetrantes.
La ecografía es una prueba adyuvante a la endoscopia para el diagnóstico de enfermedad inflamatoria intestinal colónica.
AGRADECIMIENTOS: Al Dr Ripollés por enseñarnos gran parte de lo que sabemos sobre la ecografía en esta enfermedad.