Etiopatogenia y pronóstico
El hígado es el órgano metabólico por excelencia, en el que se dirimen gran parte de los procesos que regulan el metabolismo de los hidratos de carbono y de las grasas y de la síntesis proteica. Además, es donde se acumulan oligoelementos que son vitales para el organismo, y donde se depuran sustancias que tienen efectos nocivos, otorgando al hígado un rol detoxificativo sustancial. En la cirrosis hepática, sobre todo en fases más avanzadas, la insuficiencia hepática y el desarrollo de hipertensión portal ( que puede provocar shunts portosistémicos y desarrollo de colaterales que evitan el paso de la sangre portal por el parénquima hepático), merman estas funciones y pueden conducir al paciente a tener complicaciones graves, de las cuales la desnutrición es una de las más importantes.
La desnutrición es muy frecuente en la cirrosis, se estima que la padecen entre el 25-80% de los pacientes. Este rango de prevalencia tan amplio se explica porque no hay una herramienta que sirva de "gold standard" para diagnosticarla en cirrótico, y los datos divulgados en la literatura varían según el método con el que se evalúe[1],[2]. El desarrollo de desnutrición no está vinculado a la causa de la cirrosis[3], pero es más frecuente en las fases más avanzadas de la enfermedad. Se considera que en la cirrosis compensada la desnutrición es un rasgo clínico muy poco frecuente: en este caso sólo en los pacientes cuya causa sea el alcohol puede aparecer dada la tendencia de los alcohólicos a disminuir la ingesta de alimentos en favor de un aumento en el consumo de alcohol, que ofrece un aporte calórico de muy escasa calidad[4].
La nutrición comenzó a ser objeto de interés en la cirrosis hace décadas cuando se comprobó que los cirróticos desnutridos tenían una evolución más desfavorable cuando eran sometidos a cirugía de resección hepática[5]. No obstante, con el tiempo ha perdido protagonismo como herramienta pronóstica, de forma que ninguno de los scores utilizados en la práctica clínica para clasificar la gravedad de los enfermos cirróticos, como el Child-Pugh o el MELD, la tienen en consideración. No obstante, el estado nutricional del cirrótico tiene un impacto en el pronóstico muy bien conocido: se asocia a un aumento de la morbimortalidad post-quirúrgica, incluida la del post-trasplante, se asocia a un aumento de la estancia hospitalaria, a un incremento en el riesgo de sangrado variceal, a un aumento del riesgo de infecciones y de encefalopatía hepática EH, y de ascitis y disfunción renal, incluso en pacientes Child A[6]-[9].
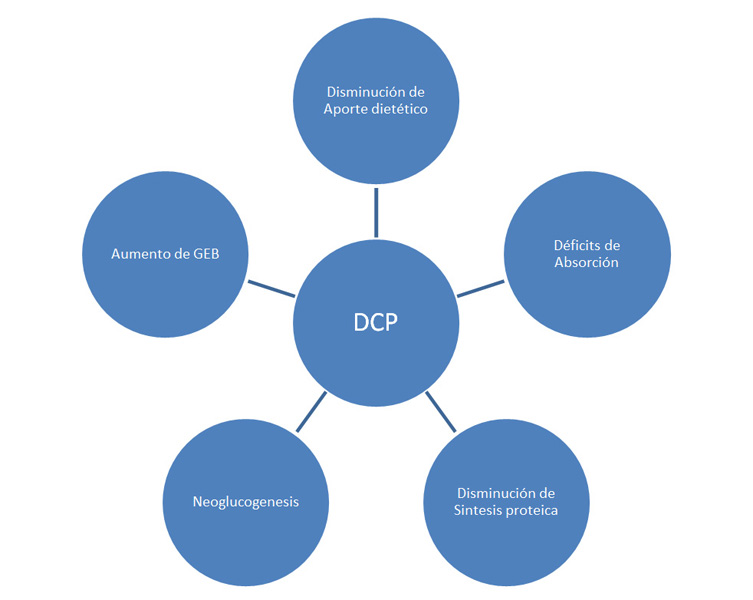
La desnutrición en la cirrosis tiene un origen multifactorial (Figura 1). Por un lado, influyen que haya un déficit en el aporte inducido por las recomendaciones dietéticas, a veces muy restrictivas a que se someten estos pacientes, la anorexia y disgeusia que produce la enfermedad, la menor palatabilidad que provoca la restricción de sal en los alimentos, y finalmente la saciedad precoz que provoca la ascitis cuando es tensa. Por otro lado concurre, a veces, una disminución en la capacidad de absorción de nutrientes producida por la colestasis que tienen algunos enfermos, la disminución del peristaltismo intestinal y el sobrecrecimiento bacteriano, pérdidas de proteínas en forma de sangrado crónico imperceptible, a lo que se suma una disminución de la capacidad del hígado para metabolizar los nutrientes que recibe[10]. Los cirróticos además, están más exigidos metabólicamente debido a que el hígado es un órgano que está en el eje de la denominada respuesta inflamatoria sistémica (RIS) que está activada por dos vías: por las alteraciones neuroendocrinas que tienen su origen en el tejido adiposo visceral, de las cuales la resistencia a la insulina (RI) tiene un rol principal, y por el estímulos de las citoquinas inflamatorias del síndrome de hipertensión portal. El resultado es un estado hipermetabólico, similar al que ocurre en la sepsis, en el que se incrementa el gasto energético basal en hasta un 20% entre el 11-34% de cirróticos[10]-[12].
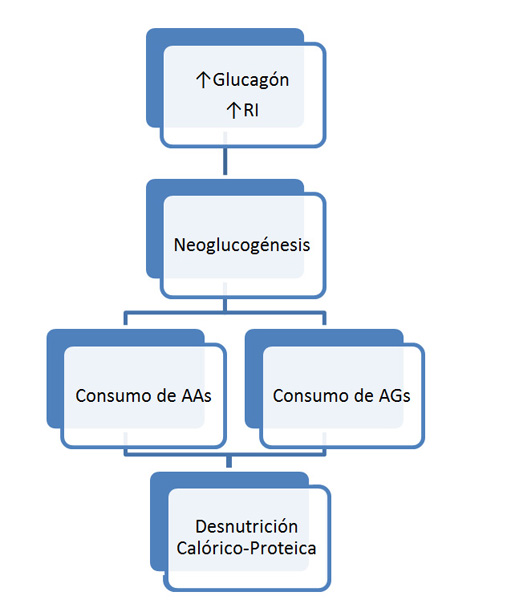
La desnutrición en la cirrosis es de componente calórico y proteico (DCP) debido a que se pierde tanto masa grasa como masa proteica[13] (Figura 2). El origen de los principales eventos fisiopatológicos que acontecen en la DCP del cirrótico es una disminución de la síntesis y depósito de glucógeno en el hepatocito y el tejido muscular, provocados por un incremento de glucagón y de la RI, ambos muy frecuentes. Esto provoca un descenso de la glucosa disponible en el lecho esplácnico procedente de los hidratos de carbono, que estimula un proceso de neoglucogénesis para obtener energía a partir de aminoácidos y de ácidos grasos. Ambos sustratos se extraen de las proteínas (sobre todo del tejido muscular estriado) y los depósitos de grasa mediante procesos de proteólisis y de lipolisis respectivamente, que están aumentados. Todo este mecanismo tan complejo contribuye, per se, a aumentar el metabolismo basal, ya que en él se consume mucha más energía de la que se consume en condiciones fisiológicas, en la que la fuente energética principal es la glucosa procedente del metabolismo de los hidratos de carbono complejos[12],[13].
Por tanto, el perfil metabólico del cirrótico desnutrido se asemeja mucho al que se produce en situaciones de ayuno prolongado o de inanición[14] con un descenso de los compartimentos muscular y graso[15]. Como se comentó previamente, muchos pacientes cirróticos tienen un aumento del gasto energético basal (GEB), bien en términos absolutos, o bien, debido a la disminución de la masa neta proteica, en términos relativos debido al menor contenido de tejido metabólicamente activo. Estos cambios en la distribución corporal se pueden acompañar, además, de un cambio en la redistribución del agua corporal cuando hay retención hidrosalina secundaria al síndrome de hipertensión portal, que provoca un aumento del espacio extracelular, incluido el del compartimento muscular[16]. Se ha constatado que el GEB puede aumentar hasta un 10% cuando hay ascitis[17].
Valoración del estado nutricional
Determinar el estado nutricional del cirrótico es un asunto clínicamente muy relevante si consideramos el impacto pronóstico que tiene. Sin embargo, el manejo en la práctica clínica tiene una serie de aspectos que lo hacen especialmente complejo, sobre todo en la cirrosis descompensada, donde resulta difícil de valorar por las características propias de la enfermedad. En la mayor parte de los contextos clínicos, las medidas antropométricas como el peso y el Indice de masa corporal (IMC), la determinación de pliegues para ponderar el compartimento graso (como el tricipital o el interescapular) o el proteico mediante la medición del perímetro braquial; los niveles séricos de proteínas como la albúmina, prealbúmina y transferrina, los test inmunológicos de alergia cutánea retardada y el recuento de linfocitos, son todas herramientas validadas.
Sin embargo en la cirrosis, muchos de éstos parámetros pueden estar alterados por causas diferentes al estado nutricional. La síntesis proteica está disminuida cuando hay insuficiencia hepática, al igual que los parámetros inmunológicos. En los pacientes cirróticos sin retención hídrica la determinación de pliegues cutáneos refleja bien el compartimento graso[18], sin embargo, cuando hay edemas y ascitis los compartimentos corporales están modificados, y por tanto, los test antropométricos habituales, sobre todo el IMC, el pliegue tricipital o intescapular y el perímetro braquial pierden sensibilidad diagnóstica y además sufren variaciones bruscas con los tratamientos depletivos, ya sean los diuréticos o las paracentesis[19], [19][20]. Se han hecho estimaciones de puntos de corte de IMC en función de la presencia o no de ascitis[21] pero necesitan mayor validación para que sean aplicables.
Existen técnicas muy sofísticadas para medir el grado de DCP y que son aplicables en la cirrosis. Entre ellas el análisis de la composición corporal mediante absorciometría de energía dual (cuyo acrónimo en inglés es DEXA) que permite hacer una ponderación de los compartimentos graso y proteico[22], la determinación del catabolismo proteico haciendo un balance del metabolismo nitrogenado[23]; o la determinación del coeficiente respiratorio, que es un método indirecto de medir el gasto energético mediante el consumo de O2 y la producción de CO2 (que también suele reflejar la composición de ambos compartimentos)[24]. Sin embargo todas ellas son técnicas complejas que no están al alcance de la mayoría de centros, y por tanto, de muy escasa aplicación clínica.
Una técnica que no reviste mucha complejidad de realización es la Impedancia Bioeléctrica (IBE). Se fundamenta en la capacidad de conducción eléctrica que tienen los diferentes tejidos corporales, y que en condiciones normales los compartimentos corporales son estables (siendo el 73% del contenido corporal total en forma de agua, y el resto componente proteico, óseo y graso). La IBE es útil porque da una idea fiel de la masa celular global[25], pero tiene una limitación de uso muy importante en los pacientes con ascitis o edemas, en los que el exceso de agua corporal total condiciona el resultado[26].
Una herramienta validada desde hace años y que se aplica habitualmente en práctica clínica para detectar riesgo nutricional (RN) es la Valoración Subjetiva Global (VSG)[27]. Consiste en un cuestionario sencillo que se puede hacer a la cabecera de cama, en el que se recogen datos clínicos como el IMC y se indaga sobre cuestiones relacionadas con los hábitos de alimentación y sobre pérdidas de peso recientes, y es ampliamente recomendado por todas las guías de nutrición[28],[29]. Es un método que sin embargo en la cirrosis tiene limitaciones[30] ya que puede infraestimarse el riesgo nutricional al ser el IMC muy dependiente de la presencia o ausencia de retención de agua.
Recientemente se ha desarrollado una variación de la VSG para los pacientes cirróticos: la denominada RFH-GSA (Royal Free Hospital-Global Subjetive Assesment)[31]. Es un esquema que incorpora el IMC calculado en base a una estimación del peso seco ideal del paciente y la circunferencia de antebrazo, junto a un cuestionario semiestructurado sobre la dieta del paciente. Este cuestionario se ha validado como una herramienta muy reproducible pero necesita personal entrenado para hacerlo, lo que limita su uso como procedimiento de cribado del RN. Por este motivo los mismos autores diseñaron una modificación de esta herramienta ( Royal Free Hospital-Nutritional Prioritizing Tool-RFH-NPT) mucho más agil, que no precisa entrenamiento específico[32] pero que necesita mayor validación clínica.
Ninguna de éstas herramientas ( medidas antropométricas, IBE, VSG o su modificación RF-GSA), tienen utilidad clínica si se utilizan de forma aislada. Parece haber consenso en que el RN ha de ser testado en los pacientes cirróticos, y probablemente la mejor opción sea recurrir a varios métodos de fácil aplicación clínica, preferiblemente que se puedad hacer a pie de cama (por ejemplo la VSG asociadas a medidas antropométricas como circunferencia de brazo y la determinación de la fuerza de pinza sean suficientes para identificar el grado de desnutrición[29]).
Sarcopenia y encefalopatía hepática
Uno de los aspectos más relevantes de la desnutrición en la cirrosis es la pérdida de tejido muscular esquelético (sarcopenia), que se produce en el 40% de los enfermos a consecuencia del aumento de la proteólisis requerida para la neoglucogénesis. Éste proceso provoca un descenso de aminoácidos esenciales de cadena ramificada (ACR) como leucina, isoleucina y valina, y un incremento Aminoácidos Aromáticos (AA)[33],[34]. Este disbalance facilita que los AA puedan actuar como falsos neurotransmisores en el SNC. El tejido muscular esquelético, por otro lado , juega un papel primordial depurando el amonio circulante[35]. Por estas dos vías, por tanto, la sarcopenia está implicada en la patogenia de la encefalopatía hepática (EH)[36]. Además de en la EH, la sarcopenia ha demostrado tener un impacto pronóstico en la mortalidad equiparable al Child-Pugh y al MELD[37], y un incremento de la mortalidad post-trasplante[38].
La sarcopenia puede resultar de más difícil diagnóstico cuando se trata de pacientes cirróticos obesos, en los que la obesidad puede asociarse a la cirrosis como una co-morbilidad, o formando parte causal de la misma (cirrosis por enfermedad grasa hepática). Este complejo sarcopenia/obesidad incrementa el estímulo de la RI y la RIS, con lo que se incrementa aún más el catabolismo y se estimula la proteólisis[39].
La sarcopenia puede ser medida determinando la fuerza y resistencia muscular por dinamometría, la más comúnmente realizada con el ejercicio de hacer pinza con la mano. Éste test se ha relacionado fielmente con el descenso de la masa celular global y los depósitos de proteínas[40,41], tiene una muy buena relación con otras herramientas de valoración nutricional[42] y se ha mostrado útil como predictor de complicaciones, especialmente EH, incluso en cirróticos compensados[43]. Los test dinamométricos tienen la ventaja de no verse influenciados por la retención de líquido, pero tienen la limitación de la escasa aplicación en las mujeres, pues en ellas la masa muscular está más preservada[15].
El contenido muscular también puede extrapolarse de la medición de áreas musculares concretas del cuerpo, y en este sentido, la determinación del área de musculatura alrededor de la vertebra L3 mediante TAC o RNM se relacionan bien con el compartimento muscular. Esta herramienta ha sido estudiada sobre todo en población de edad avanzada y oncológica[44],[45] y requieren mayor validación futura como predictores pronósticos de la cirrosis.
Tabla 1
Factores que influyen en la desnutrición GEB: Gasto Energético Basal; DCP: Desnutrición Calorico-Proteica.
Recomendaciones nutricionales
Si tenemos en cuenta que los rasgos que definen la desnutrición en la cirrosis son el aumento del gasto energético basal y el estado hipercatabólico[24],[46], el soporte nutricional del cirrótico ha de ser hipercalórico e hiperproteico. Como se comentó previamente, la neoglucogénesis crea en el cirrótico un estado especial, similar al que ocurre en las situaciones de ayuno muy prolongado, sin que el cirrótico tenga capacidad de adaptarse a ello disminuyendo su metabolismo basal. La manera de paliar los efectos de este fenómeno es acortar los periodos de ayuno mediante la distribución de esta dieta hipercalórica e hiperprotéica en 4-6 tomas diarias, que permitan que haya siempre sustrato disponible para no recurrir al aporte de aminoácidos y ácidos grasos endógenos. Este recurso es especialmente beneficioso en la EH, dada la estrecha relación de las reservas de glucógeno y el amonio[51]. Es conveniente que este reparto de las tomas diarias se acompañe además de un suplemento nocturno de hidratos de carbono para que el periodo de ayuno nocturno sea lo más corto posible[52] (Tabla 1).
Las guías[29] recomiendan un aporte calórico de 35-40 Kilocalorías/ Kilogramo (Kcal/kg) de peso usando como referencia el peso ideal (el peso magro podría suponer un descenso del aporte y el peso real del paciente, si hay edemas y ascitis, puede conllevar una incremento del aporte energético). En relación al aporte proteico, debe ser de 1.2-1.5 g/kg dia, también utilizando como referencia el peso ideal del paciente. Si el paciente tiene capacidad para realizar este aporte con una dieta variada no son necesarios aportes nutricionales. Sin embargo, si el paciente no va a poder garantizar la ingesta de una dieta que reúna estas características, se debería usar suplementos de alimentación enteral, administrados preferiblemente por vía oral. Si la vía oral no permite garantizar este aporte se recomienda el uso de sondas de alimentación enteral naso-duodenal o nasoyeyunal. Cuando se requieran suplementos nutricionales en situaciones en las que haya que restringir líquidos, se recomienda hacerlo con suplementos hipercalóricos que aporten 1.5 Kcal/ml. Estas recomendaciones son válidas como estrategia de mantenimiento, pero cuando se incrementa el estrés metabólico, o cuando se precisa incrementar el peso por desnutrición más severa, hay que incrementar el aporte para hacer un balance positivo (Tabla 2).
Las recomendaciones nutricionales en los pacientes con EH no deben diferir de las del cirrótico sin ésta complicación. Las restricciones proteicas, tan habituales hace años para el manejo de la EH, se deben evitar, ya que estos pacientes toleran sin problema dietas no restrictivas en proteínas)[48]. Sólo en situaciones especiales, como la hemorragia digestiva en la que ya hay un exceso de aporte de proteínas intestinales procedente del sangrado, o durante periodos de tiempo muy cortos en la EH aguda se debe hacer restricción de proteinas. Por tanto, como regla general, los pacientes cirróticos desnutridos, independientemente de la EH, han de ser nutridos con dietas hipercalóricas e hiperproteicas.
Se ha debatido mucho sobre la fuente ideal de las proteínas que debe tomar el cirrótico. Aunque las guías recomiendan recurrir predominantemente a proteínas de origen vegetal y lácteo por que tienen sobre el papel un beneficio teórico ( mayor aporte de fibra, efecto beneficioso en la microbiota etc..), la evidencia del beneficio clínico parece menos consistentel[53]. En relación al aporte de ACR, su uso por vía intravenosa está justificado en la EH aguda, pero es controvertido el efecto beneficioso que tiene el aporte oral de ACR en la disminución del riesgo de EH[54],[55] aunque un aporte adicional ACR ha demostrado mejorar el balance proteico, y por tanto a incrementar la masa de tejido muscular[56], por lo que se recomienda su uso en aquellos casos que no se toleren otro tipo de proteínas (como por ejemplo en casos de intolerancia a lactosa en los que se puede limitar el uso de derivados de la leche )
Como se expuso previamente, una asociación cada vez más usual es la del paciente cirrótico obeso , en el que la desnutrición (sobre todo la sarcopenia) puede quedar enmascarada por el sobrepeso. Esta situación no es fácil de manejar. Parece que la recomendación general de hacer ejercicio físico y una dieta con leves restricciones dietéticas puede ser segura en pacientes cirróticos compensados, sin embargo en los pacientes descompensados las reducciones de peso deben ser muy cautelosas y basarlas en una reducción de contenido de hidratos de carbono y grasas incrementando el aporte proteico, sin que se incremente el riesgo de encefalopatía incluso con aportes por encima de 2 gr/kg[49]. Éstas opciones de manejo se resumen en la tabla 2, que recoge las recomendaciones de la International Society for Hepatic Encefalopathy and Nitrogen Metabolism (ISHEN), considerando las diferentes posibilidades en función del estado nutricional y el grado de sobrepeso[50].
Tabla 2
Manejo nutricional de pacientes cirróticos con EH50
Conclusión
La desnutrición es frecuente en la cirrosis descompensada e impacta en el pronóstico, por lo que el abordaje para detectarla y tratarla debería ser planificado en la práctica clínica habitual. El soporte nutricional debe hacerse con dietas hipercalóricas e hiperproteicas en base al tipo de desnutrición que tienen estos enfermos, independientemente de la presencia de encefalopatía.