Síndrome de intestino irritable
El síndrome de intestino irritable (SII) es un cuadro crónico caracterizado por dolor abdominal recurrente asociado a cambios en el ritmo intestinal (diarrea, estreñimiento o ambos) acompañado o no de una sensación de distensión abdominal, sin que exista una alteración morfológica, metabólica o infecciosa que lo justifique[1]. Durante las últimas décadas para el diagnóstico de SII se han desarrollado unos criterios clínicos, iniciados con los criterios de Manning en 1978 y continuados con los sucesivos criterios de Roma. Recientemente se han publicado los Criterios de Roma IV[2] que establecen como requisitos la presencia de dolor abdominal recurrente (durante al menos los últimos tres meses y que hayan empezado al menos seis meses antes), al menos un día a la semana que se asocia a dos o más de las siguientes características: a) se asocia a la defecación b) está relacionado con un cambio en la frecuencia de las deposiciones y c) está relacionado con un cambio en la consistencia de las heces.
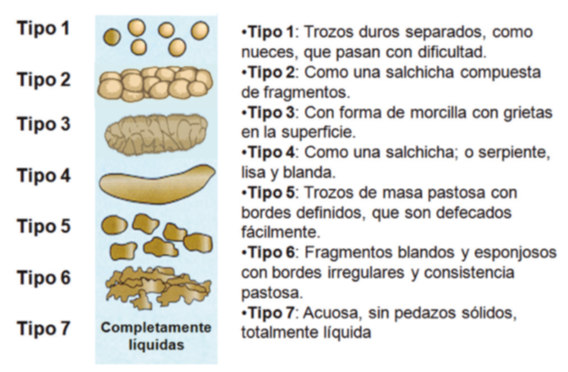
Existen cuatro subtipos de SII definidos en función del hábito predominante en los momentos de la alteración de la defecación. Para ello es de gran utilidad la escala Bristol de clasificación de las deposiciones (Figura 1) y que nos permite distinguir: SII con estreñimiento (SII-E) con deposiciones tipo Bristol 1 y 2 en el mayor porcentaje de tiempo o bien SII con diarrea (SII-D) si el predominio son deposiciones tipo Bristol 6 o 7. Si se alternan deposiciones de ambos tipo estaríamos ante un SII de tipo mixto (SII-M) o de SII de tipo indeterminado (SII-I) cuando el patrón de las deposiciones es intermedio y no puede clasificarse como diarrea ni estreñimiento[1],[2].
Epidemiología
El SII es una patología con una elevada prevalencia, así en Europa oscila entre un 2% y 22% de la población. En la población española datos recientes establecen la prevalencia en el 8,3%[3]. Del total de las consultas recibidas en gastroenterología hasta un 35% se relacionan con trastornos funcionales digestivos intestinales. Junto al impacto económico directo e indirecto, el SII implica un importante impacto en la calidad de vida de los pacientes que lo presentan. La calidad de vida relacionada con la salud (CVRS) de los pacientes con SII está notablemente alterada, como reflejan varias revisiones al respecto[4],[5]. A su vez, los costes asociados al SII son importantes. Baste citar que sólo en Estados Unidos consultan anualmente por este problema 3,5 millones de personas, lo que supone un gasto anual de 20.000 millones de dólares[6]. Datos obtenidos en Europa, y específicamente en España, también demuestran el incremento de los costes directos e indirectos en los pacientes con SII-E[7].
Fisiopatología
La fisiopatología del SII es compleja y multifactorial incluyendo predisposición genética, hipersensibilidad visceral, disregulación del sistema nervioso, anomalías de la motilidad gastrointestinal, de la función secretora, permeabilidad, activación inmunitaria y la composición de la microbiota intestinal. También existen evidencias de una disregulación del eje cerebro-intestinal, efectos de género y sexo y factores psicosociales como la historia de abusos sexuales como determinantes claves en el desarrollo del SII[8]. La hipersensibilidad visceral es probablemente el factor patológico más importante en el desarrollo del SII y se asocia a síntomas de dolor y malestar que vemos en los pacientes con SII. Los pacientes presentan comúnmente un umbral más bajo de respuesta a estímulos dirigidos a las terminales sensitivas viscerales. Este descenso del umbral de respuesta se traduciría en principio en el desencadenamiento de fenómenos de motilidad con mayor frecuencia que en los individuos sanos[9].
Por otro lado, se ha involucrado a la interacción entre los factores dietéticos (carbohidratos, lípidos y proteínas) con la microbiota. Como consecuencia se origina un aumento en la producción de gas y por alteraciones en la permeabilidad intestinal se facilita el paso de macromoléculas que conlleva la activación de la degranulación de los mastocitos y la activación del sistema inmune. Este hecho es la base para que los mecanoreceptores y la vía sensitiva se active en probablemente sujetos condicionados genéticamente. A esto se le suma que se puede afectar directamente la barrera intestinal y favorecer el paso de esas macromoléculas como son inmunoglobulinas, interleucinas, etc[10].
Aunque quedan muchos factores por establecer entenderíamos la fisiopatología del SII como un sumatorio en donde a sujetos condicionados de forma genética se le sumarían factores ambientales (historia de abusos, gastroenteritis aguda, otros factores) que conllevarían un anormal procesamiento de las señales a nivel del SNC, que junto a hipersensibilidad visceral, disfunción autonómica, aumento en la permeabilidad intestinal, alteraciones en la microbiota y serotonina generarían que la interacción con los alimentos y factores psicológicos como el stress condicionarían síntomas que conducirían a los pacientes a nuestras consultas[11].
Dolor abdominal funcional
El dolor abdominal funcional se caracteriza por la presencia de dolor abdominal de larga evolución, sin aparente relación con la ingesta o con la defecación y con una intensidad suficiente como para interferir en la vida diaria del paciente, y que no se debe a enfermedades orgánicas, metabólicas ni infecciosas[12].
Al igual que ocurre en el SII, el grupo de trabajo de Roma ha establecido los siguientes criterios para su diagnóstico (deben cumplirse en los últimos tres meses iniciándose al menos seis meses antes del diagnóstico):
- Dolor abdominal continuo o muy frecuente.
- Sin relación o sólo ocasional con procesos fisiológicos.
- Debe provocar alguna pérdida de la actividad diaria del paciente.
- El dolor no debe ser fingido.
- No presenta otros síntomas que le permitan cumplir criterios de trastorno funcional.
La prevalencia del dolor abdominal es inferior a la del SII, oscilando entre un 0,5% y un 2% en función del estudio. Es más prevalente en mujeres con un ratio respecto a varones de 3:2 y suele aparecer en la cuarta década de la vida.
En relación con su fisiopatología hay que considerar que en los pacientes con dolor abdominal funcional existe una percepción anómala de la función intestinal en relación a diversos estímulos como pueden ser la ingesta, las deposiciones, la menstruación etc, pero puede existir dolor aún en ausencia de estímulo intestinal que provoque la sintomatología, es decir, una auténtica percepción anómala de la función intestinal normal. El principal mecanismo sería una alteración central en los sistemas de modulación endógena del dolor mediante una inhibición o incluso una amplificación de la regulación normal de los estímulos sensitivos aferentes.
El abordaje diagnóstico debe estar guiado por una adecuada historia clínica y exploración física. No existen algoritmos específicos para el estudio del dolor abdominal crónico, por lo que la realización de exploraciones complementarias debe decidirse de forma individualizada.
Es fundamental descartar la presencia de síntomas y signos de alarma. En la historia clínica es importante discernir si el dolor se asocia a ingesta, defecación o menstruación, en cuyo caso habría que considerar una afección orgánica u otros trastornos funcionales.
Los pacientes con dolor abdominal crónico suelen expresar la presencia de dolor de forma verbal y no verbal, demandan la realización de múltiples exploraciones complementarias, esperan la desaparición completa de sus síntomas con el tratamiento y rechazan la implicación de factores psicosociales en su patología.
Se debe distinguir del dolor crónico de la pared abdominal mediante la prueba de Carnett, que consiste en pedir al paciente en decúbito supino que flexione el tronco mientras el médico se opone a éste movimiento presionando sobre la frente del paciente, si el dolor abdominal aumenta sugerirá que es somático y se localiza en la pared abdominal. Otros signos habituales durante la exploración son el signo de los ojos cerrados (los pacientes cierran los ojos mientras el médico efectúa la palpación abdominal) y el signo del estetoscopio (durante la palpación abdominal con el estetoscopio la respuesta al dolor es menor).
Otro de los aspectos que requiere el diagnóstico del síndrome de dolor abdominal funcional es que el dolor no sea simulado. A veces este aspecto es difícil de asegurar y hay que tener pruebas claras de esa simulación, porque el hecho de plantearla puede romper la relación médico-paciente que en este tipo de enfermos es fundamental desde el punto de vista de manejo terapéutico.
Diagnóstico de SII
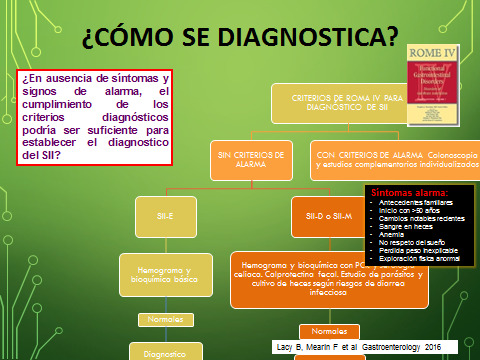
En gran parte de las ocasiones, una anamnesis detallada y una exploración física adecuada podrían ser suficientes para descartar enfermedad orgánica y realizar un diagnóstico empírico de SII. En ausencia de síntomas de alarma, la realización de exploraciones complementarias depende del nivel de incertidumbre que tanto médico como paciente estén dispuestos a aceptar. El diagnóstico debe fundamentarse en los síntomas característicos que se han sistematizado en los criterios de Roma IV, aunque ello no exime de realizar las exploraciones pertinentes para establecer el diagnóstico diferencial con algunas patologías orgánicas que pueden manifestarse de forma similar. Otro aspecto que debemos considerar es la realidad del solapamiento del SII con otros trastornos funcionales intestinales (como el estreñimiento funcional o la diarrea funcional), con otros trastornos funcionales digestivos no intestinales (como la dispepsia funcional o la pirosis funcional) o extradigestivos (como la fibromialgia o la cistitis intersticial) puesto que es muy frecuente que coexistan en el mismo paciente[13],[14].
Los síntomas de alarma son los siguientes:
- Antecedentes familiares de neoplasia digestiva.
- Inicio de los síntomas a edad superior a 50 años.
- Cambios notables recientes en la sintomatología.
- Presencia de sangre en heces.
- Anemia.
- Pérdida de peso no explicable.
- Presencia de síntomas nocturnos.
- Exploración física anormal.
Ante un paciente con sospecha clínica de SII-E, sin criterios de alarma y una analítica sanguínea con hemograma y bioquímica básica normales, se puede establecer el diagnóstico de SII-E. En este mismo caso pero con predominio de diarrea o síntomas mixtos, además es conveniente ampliar el estudio con proteína C reactiva, calprotectina fecal y serología de enfermedad celiaca. Si se sospecha un origen infeccioso de la diarrea, solicitar parásitos y coprocultivo (Figura 2).
Estrategia de manejo del SII y del dolor abdominal funcional
Para el manejo de estas dos entidades SII y dolor abdominal funcional debemos pilotar en tres puntos claves como son establecer unos consejos generales, unas recomendaciones dietéticas y un abordaje con terapia farmacológica.
Consejos generales: para el manejo del paciente con SII o dolor abdominal funcional es primordial establecer una adecuada relación médico-paciente, conseguir su confianza. Los aspectos más importantes son explicarle, siempre empleando términos que comprenda, la naturaleza de sus síntomas y el curso benigno de su patología y la existencia de deficiencias en el conocimiento de la etiología y tratamiento. No se deben minusvalorar los síntomas del paciente, ya que éstos son reales.
Recomendaciones dietéticas: la dieta es uno de los mayores problemas que plantean los pacientes con SII y dolor abdominal funcional. Intervenir sobre la dieta puede resultar útil cuando el origen de los síntomas se relaciona con malabsorción de hidrocarbonados o con una sensibilidad al gluten no celíaca, si bien, en la mayoría de los pacientes las percepciones se correlacionan poco con las malabsorciones verdaderas. Con el objetivo de no incurrir en deficiencias nutricionales, no es recomendable aconsejar al paciente excesivas restricciones en la dieta, y tan sólo evitar aquellos alimentos que le desencadenen síntomas. La dieta basada en recomendaciones dietéticas saludables del National Institute for Health And Care Excellence (NICE), en Reino Unido es la que más evidencia científica[15].
Por otra parte, una extensión de la hipótesis de la intolerancia a distintos hidratos de carbono en el SII ha llevado a plantear una dieta exenta de oligosacáridos, disacáridos, monosacáridos y polioles fermentables (FODMAP). Hay datos controvertidos de tal forma que en un estudio aleatorizado, 41 pacientes con SII recibieron dieta baja en FODMAP o su dieta regular. El 68% de los pacientes que recibieron dieta baja en FODMAP refirió control adecuado de los síntomas con respecto al 23% que continuó con su dieta habitual (p=0,005). La consistencia de las heces no se modificó en ambos grupos[16]. No obstante, en un estudio reciente, la dieta baja en FODMAP no fue superior al consejo dietético clásico en el SII[17]. La Asociación Británica de Dietistas acaba de proponer un algoritmo de dieta escalonada con restricciones básicas en un primer escalón y si se produce escasa respuesta o sin esta plantear una dieta restrictiva en FODMAP durante sólo unas semanas evaluando su eficacia. Si hay mejoría de síntomas se plantearía una fase de reintroducción progresiva. La reintroducción se hará por grupos de alimentos con alto contenido de lactosa, fructosa y polioles, fructanos y oligosacáridos, Esta estrategia tiene el objetivo de identificar qué alimentos y hasta qué cantidad de los mismos puede tolerar cada paciente pero en ausencia de respuesta se debería mantener una dieta no restrictiva[18].
Tratamiento farmacológico
Los tratamientos empleados para el SII y dolor abdominal son múltiples, pero su eficacia es limitada. En la práctica, el tratamiento debe orientarse en función de la sintomatología predominante. Algunos fármacos pueden ejercer su acción sobre varios síntomas. Así en paciente con predominio de estreñimiento disponemos de fibra, laxantes osmóticos y linaclotida. Para el caso en el que el síntoma predominante sea diarrea disponemos de colestiramina, loperamida y rifaximina. Como analgésicos para controlar cuando el síntoma predominante sea dolor se empleará espasmolíticos, linaclotida y antidepresivos. En caso de predominio de distensión abdominal puede ser útil linaclotida y rifaximina. Los probióticos pueden mejorar los síntomas tanto de pacientes con predominio de distensión como dolor abdominal o diarrea.
Manejo del estreñimiento
En pacientes con predominio de estreñimiento, el primer escalón terapéutico se basa clásicamente en utilizar fibra soluble (psyllium). Se desaconseja utilizar fibra insoluble puesto que no mejora los síntomas vinculados al estreñimiento. Se recomienda utilizar dosis de 25-30 gr/día de fibra soluble y se aconseja un aumento gradual para evitar la distensión abdominal estableciéndose su duración en seis semanas para evaluar su eficacia y en el caso de no resultar eficaz evaluar otras alternativas. Sin embargo, aunque esta medida puede mejorar la frecuencia defecatoria y la consistencia de las heces, puede empeorar otros síntomas como el dolor y la distensión abdominal. Por otra parte, en casos de estreñimiento grave con importante enlentecimiento del TTC, la dieta con alto contenido en fibra no es eficaz y puede empeorar el dolor y la distensión.
Los laxantes osmóticos contienen iones no absorbibles o moléculas que retienen agua en la luz intestinal. Los más utilizados son el polietilenglicol (PEG), la lactulosa y las sales de magnesio. Este tipo de laxantes mejoran el estreñimiento y la consistencia de las heces, pero se obtiene una pobre respuesta en el dolor y la distensión abdominal. La mayor evidencia, por los estudios disponibles, es para el PEG, pero las sales de magnesio se utilizan frecuentemente en la práctica clínica con resultado satisfactorio. El PEG es más eficaz que la lactulosa en el control de los síntomas y produce menos efectos secundarios, por lo que debe considerarse como fármaco de primera elección dentro de este grupo. Tienen un buen perfil de seguridad y, por lo tanto, se puede utilizar en situaciones específicas, como en ancianos, durante el embarazo y en pacientes con insuficiencia renal y hepática[19].
Los laxantes estimulantes favorecen la secreción de agua y electrolitos en el colon o inducen la peristalsis del mismo. Entre los laxantes estimulantes se incluyen los difenilmetanos (fenolftaleína, bisacodilo, picosulfato sódico) y las antraquinonas (Senna, cáscara sagrada, Aloe vera). Los laxantes estimulantes son útiles para el tratamiento del estreñimiento, aunque menos eficaces para controlar el dolor y la distensión abdominal, por lo que su utilidad es muy limitada en el SII-E. Su perfil de seguridad es menor que el de los laxantes osmóticos.
La alternativa actualmente en los pacientes en los que los laxantes fracasan es la linaclotida, que ha demostrado su eficacia tanto en el aumento del número de deposiciones como en la disminución del dolor y sensación de distensión abdominal. La linaclotida es una agonista de la guanilato ciclasa C, cuyo estímulo produce un aumento del guanosín monofosfato cíclico (GMPc) intracelular en el enterocito. Este GMPc actúa a nivel intracelular produciendo un aumento de la secreción de bicarbonato y cloro hacia la luz intestinal y se difunde al espacio extracelular ejerciendo una acción sobre las terminaciones sensitivas, disminuyendo su actividad. Desde el punto de vista farmacodinámico, el efecto final es un aumento de la secreción intraluminal con la consiguiente aceleración del tránsito y un efecto analgésico visceral, con disminución de umbrales sensitivos a la distensión mecánica. La linaclotida no se absorbe y no pasa a la circulación sistémica[20], ni actúa sobre el citocromo P450; por ello, aunque no se ha estudiado específicamente en pacientes con insuficiencia hepática o renal, no cabe pensar que exista ninguna limitación para su uso en este tipo de pacientes. Su eficacia y seguridad son similares tanto en el anciano como en el adulto de mediana edad.
Manejo de la diarrea
Se ha empleado la colestiramina de forma empírica para el control de la diarrea y de la urgencia defecatoria ya que existen datos que apoyan el papel de los ácidos biliares en la diarrea, ya sea en forma de malabsorción, aumento de la síntesis o hipersensibilidad. En una estudio reciente se ha demostrado su eficacia en la reducción del número de deposiciones líquidas diarias tras una semana de tratamiento[21].
La loperamida a dosis bajas, como se demostró en un metaanálisis, consigue reducir la frecuencia y aumentar la consistencia de las deposiciones, pero no ha resultado ser más eficaz que placebo para el control del dolor.
La rifaximina, es un antibiótico poco absorbible, que actúa intraluminalmente, con nulo efecto sistémico. Impide la adherencia de los patógenos a la mucosa intestinal y la invasión de las células epiteliales por estos, al unirse a la subunidad β de la ácido ribonucleico (ARN) polimerasa microbiana, inhibiendo de este modo la transcripción y la síntesis de ARN. Administrada a dosis de 550 mg cada 8 horas durante dos semanas ha demostrado aliviar los síntomas de SII-D (tanto la diarrea como la distensión abdominal), probablemente como consecuencia del control del sobrecrecimiento bacteriano intestinal o de la reducción de las bacterias cólicas implicadas en la fermentación intestinal. Su limitación reside en su efecto tan sólo a corto plazo, aproximadamente 2-4 semanas. Se plantea la posibilidad de repetir la dosis en forma de ciclos para optimizar su efecto terapéutico[11].
Manejo del dolor
Los espasmolíticos son relajantes del músculo liso se emplean frecuentemente para el tratamiento del SII y del dolor abdominal funcional. Se distinguen tres clases principales: antagonistas de canales del calcio (otilonio y pinaverium), relajantes directos del músculo liso (mebeverina) y anticolinérgicos/antimuscarínicos (hioscina, cimetropium, hidrocloruro de diciclomina). En diversos ensayos clínicos, revisiones y metaanálisis se ha comprobado su eficacia en el tratamiento del dolor y en la mejoría global pero no tienen acción sobre el estreñimiento[19].
Los fármacos psicotrópicos han sido evaluados en estudios clínicos sobre todo en casos de SII con predominio de dolor. En SII y dolor abdominal funcional se han probado antidepresivos tricíclicos (ADT), inhibidores selectivos de la recaptación de serotonina (ISRS), inhibidores selectivos de la recaptación de serotonina-noradrenalina (ISRSN) y antipsicóticos atípicos. Los ADT (amitriptilina, desipramina) son los más estudiados y empleados en trastornos funcionales digestivos, modulan la percepción del dolor a nivel central y están especialmente indicados en pacientes con SII-D y dolor abdominal funcional que no responden a otros tratamientos. Los ISRS (paroxetina, citalopram) pueden estar indicados en pacientes con SII sin estreñimiento. De entre los ISRSN (duloxetina, venlafaxina, desvenlafaxina), sólo la duloxetina ha sido estudiada en pacientes con SII y ha demostrado su eficacia en el control del dolor y una mejoría en la consistencia de las deposiciones. Los antipsicóticos atípicos como la quetiapina, deben reservarse exclusivamente a pacientes con SII y dolor abdominal funcional que no han respondido al tratamiento con otros antidepresivos y siempre emplearse a dosis menores a las utilizadas en psiquiatría[11].
Los probióticos son bacterias vivas que poseen diversas características como son la supervivencia en el tracto gastrointestinal, la adherencia al epitelio intestinal y la modulación de la flora intestinal, inhibiendo las bacterias potencialmente patógenas y produciendo diversos efectos inmunomoduladores e inmunoestimulantes, como el estímulo para la proliferación de células inmunitarias, el aumento en la actividad de las células fagocíticas o el incremento en la producción de IgA.
Todo ello determina su potencial efecto beneficioso en la prevención de infecciones, especialmente por patógenos de origen intestinal, y de la translocación bacteriana. Su utilización está emergiendo como alternativa en el tratamiento del SII.
Existen varios estudios en la literatura, incluidos metaanálisis[22] que muestran un beneficio de los probióticos proporcionando un alivio de síntomas como meteorismo, flatulencia, hinchazón, estreñimiento e incluso del dolor abdominal.
A modo de conclusiones podemos sintetizar que los nuevos criterios Roma IV se proponen como una nueva actualización de la definición del síndrome de intestino irritable. Esta entidad es frecuente y trascendente puesto que impacta de forma evidente en la calidad de vida de nuestros pacientes.
Debemos considerar que su fisiopatología es multifactorial y que coexiste en el mismo paciente con otras entidades de perfil funcional como la dispepsia. Su diagnóstico es clave para poder ofrecer opciones de tratamiento, aunque este diagnóstico se puede establecer con incertidumbre que tanto el paciente como el médico responsable deben de saber balancear. Disponemos de herramientas terapéuticas útiles aunque el margen de mejora en este aspecto es evidente.

 Descargar número completo
Descargar número completo Download full issue
Download full issue