CITA ESTE TRABAJO
Calvo Bernal MM, Moya Montoya MM, Campos Serrano N, Jácome Pérez AP, Aparicio Mota A, Casado Martín M.Infección por el virus de la hepatitis B, C, VIH y patología hepática en pacientes con infección por SARS-CoV-2. Implicaciones clínicas. RAPD Online. 2022;45(6):535-540.
Introduction
Las hepatitis víricas constituyen un importante problema de salud pública global por su alta prevalencia y morbimortalidad. Así, la Organización Mundial de la Salud (OMS) ha establecido como uno de sus objetivos la eliminación de las hepatitis víricas para el año 2030[1]. España es uno de los países mejor posicionados para conseguir el objetivo de la eliminación de la hepatitis C debido a su elevada tasa de tratamiento, sin embargo son necesarias estrategias de cribado en diferentes grupos de elevada prevalencia para aumentar la tasa de diagnóstico[2].
La pandemia COVID-19 ha tenido un importante impacto en las estrategias de eliminación del virus de la hepatitis C en nuestro país, al haber condicionado una pausa en la ejecución de las mismas, lo cual ha supuesto un retraso en el diagnóstico así como una disminución del número de tratamientos iniciados, con potenciales consecuencias dramáticas en términos de salud[3].
Por otra parte, la infección por SARS-CoV-2 puede tener un importante impacto en los pacientes con infección desconocida por VHC y VHB por dos motivos. En primer lugar, el uso de altas dosis de corticoides y diferentes fármacos inmunosupresores como el tocilizumab en el tratamiento de la COVID-19 conlleva la posibilidad de reactivación de infecciones virales subyacentes. En segundo lugar, disponemos de evidencia de un peor pronóstico de la infección por SARS-CoV-2 en pacientes con enfermedad hepática crónica de base[4], fundamentalmente en pacientes con cirrosis pero también en pacientes con fibrosis hepática avanzada, con un incremento del riesgo de mortalidad asociada a la COVID-19. Además, la infección por SARS-CoV-2 puede agravar una enfermedad hepática crónica subyacente, aumentando el riesgo de descompensación y condicionando una mayor mortalidad de causa hepática[5].
Es por ello que el protocolo COVID elaborado por el ministerio de Sanidad recomienda el cribado de infección VHB, VHC y VIH en todos los pacientes que ingresen en un hospital por neumonía con infección por SARS-CoV-2[6],[7]. Así, la pandemia COVID-19 podría ser una oportunidad para aumentar las tasas de diagnóstico de la infección VHC, VHB y VIH.
Pese a ello, hasta la fecha, disponemos de pocos datos en relación a la prevalencia de la infección VIH, VHB y VHC en pacientes con COVID-19 así como su evolución en relación a pacientes sin infección viral subyacente.
Por otra parte el virus SARS-CoV-2 puede condicionar daño hepático bien por efecto citopático directo, como consecuencia del síndrome de respuesta inflamatoria sistémica secundario o por hepatotoxicidad de los fármacos usados para el tratamiento de dicha infección, y cuya repercusión clínica, hasta la fecha, no es bien conocida[8].
Los objetivos del presente estudio han sido: 1.- Evaluar el resultado de una estrategia de cribado de la infección por VHC, VHB y VIH en pacientes hospitalizados con COVID-19, 2.- Evaluar el efecto de la infección por SARS-CoV-2 en la analítica hepática y su repercusión clínica y 3.- Analizar la evolución clínica de los pacientes con COVID19 e infección viral subyacente o patología hepática previa.
Material y Métodos
Hemos llevado a cabo un estudio unicéntrico observacional retrospectivo en el Hospital Universitario Torrecárdenas de Almería. Para ello hemos incluido en nuestro estudio la totalidad los pacientes ingresados por infección por el virus SARS-CoV-2, con clínica compatible con dicha infección, desde el inicio de la pandemia en marzo del 2020 hasta noviembre de 2020.
Los datos del estudio han sido recogidos de las historias clínicas de los pacientes a través del programa "Diraya". Se han analizado variables epidemiológicas (edad, sexo, consumo de alcohol y tabaco, etnia, serología al ingreso (VHB, VHC y VIH), días de estancia en unidad de cuidados intensivos (UCI) y de estancia total; clínicas (Hipertensión arterial, diabetes mellitus, obesidad, cardiopatía isquémica, enfermedad pulmonar obstructiva crónica, dislipemia, enfermedad hepática previa, cirrosis, infección viral previa conocida, neumonía por SARS-CoV-2, tratamiento con corticoides, inmunosupresores, uso de oxigenoterapia alto flujo (ONAF), uso de ventilación mecánica no invasiva (VMNI), intubación orotraqueal (IOT), ingreso en UCI, exitus; y analíticas (elevación de transaminasas al ingreso y durante la hospitalización, linfopenia, plaquetopenia, media de aspartato aminotransferasa (AST), alanina aminotrasnferasa (ALT), lactato deshidrogenasa (LDH), proteína C reactiva (PCR), interleucina 6 (IL6), dímero D y ferritina.
El estudio ha sido aprobado por el comité de ética de nuestro hospital.
Para el análisis de datos hemos utilizado el programa estadístico IBM SPSS Statistics, versión 24. Para el contraste de hipótesis de igualdad de medias se utilizará el test de la t de Student para muestras independientes si estas se distribuyen según una distribución normal, en caso contrario se utilizará el test de Mann-Whitney. Para el contraste de hipótesis de igualdad de frecuencia en las variables cualitativas se utilizará el test Chi-Cuadrado de Pearson y el test exacto de Fisher. Se ha comprobado la normalidad de las variables cualitativas con el test de Kolmogorov-Smirnov. Se ha utilizado un modelo de regresión logística múltiple para la estimación de la mortalidad.
Resultados
El estudio ha incluido un total de 476 pacientes. Un 65% fueron varones. La edad media fue de 63 años, el 61 % con edades comprendidas entre los 18 y los 69 años.
El resto de características de los pacientes incluidos se resumen en la tabla 1.
Tabla 1
Características demográficas y clínicas de los pacientes incluidos en el estudio.
Pese a que el protocolo de nuestro hospital, recoge el cribado de infección subyacente VHC, VHB y VIH en la analítica de ingreso de los pacientes con infección por SARS-CoV-2, tan solo se realizó esta determinación en 238 pacientes (50%).
Del total de los pacientes con infección por Covid-19 a los que se realizó serología viral al ingreso, 5 pacientes fueron diagnosticados de infección crónica por VHB no conocida previamente, (2,1%) y 3 pacientes fueron diagnosticados de infección crónica activa por VHC (1,3%). Ningún paciente fue diagnosticado de infección por VIH.
Cuatro de los 8 pacientes diagnosticados de infección crónica por VHB o VHC fueron tratados con altas dosis de corticoides y ninguno fue tratado con inmunosupresores.
La evolución clínica de estos pacientes fue similar al resto de la serie. Las cifras de AST, ALT, LDH, PCR, IL6, Dímero D y ferritina fueron similares en los pacientes diagnosticados de infección viral crónica subyacente en relación al resto de pacientes incluidos.
Del total de pacientes con infección subyacente por VHB o VHC, ningún paciente falleció, ni precisó IOT, ONAF, VMNI, ni fue ingresado en UCI. Tampoco precisaron una estancia hospitalaria mayor, con una estancia media de 7 días (p= 0,16).
Durante la hospitalización 294 pacientes (64%) presentaron elevación de AST (>40 UI/L) y ALT (>40 UI/L) de forma mantenida, de ellos, 122 mostraban dichas alteraciones al ingreso. El 95% presentaron hipertransaminasemia de bajo rango (300 UI) y uno presentó fallo hepático agudo.
El subgrupo de pacientes tratados con inmunosupresores presentó cifras de ALT más elevadas que los pacientes que no recibieron este tratamiento. (136,24 vs 89,33, p=0,004).
La evolución clínica de los pacientes con transaminasas elevadas fue similar a los que las mantuvieron normales excepto la mortalidad, que fue significativamente inferior en este grupo de pacientes (13,9% vs 23,6%, p=0,009). No se encontraron diferencias estadísticamente significativas en relación a la necesidad de IOT, ONAF, VMNI e ingreso en UCI.
El 5,7% (27) del global de pacientes presentaban alguna patología hepática previa al ingreso. De éstos, 6 pacientes (1.3%) eran cirróticos, 5 tenían infección previa en tratamiento activo por VHB, 1 infección previamente conocida por VHC y 2 coinfección VIH+VHC.
La evolución clínica y analítica de los pacientes con patología hepática previa fue similar al resto de pacientes. La evolución clínica de los pacientes con cirrosis hepática fue similar a los pacientes sin cirrosis.
Para identificar las variables asociadas a la mortalidad en el global de la serie realizamos un análisis multivariante. Las variable asociada de forma independiente a la mortalidad fue la linfopenia (OR 7,85, IC 95% 2,85-21,61, p<0,001). Por otra parte, la elevación de las transaminasas se relacionó con una menor mortalidad (OR 0,38, IC 95% 0,2-0,7, p=0,003).
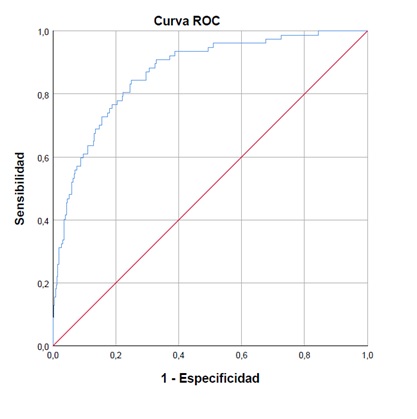
La prueba de Hosmer y Lemeshow fue no significativa (p=0,87). El área bajo la curva fue de 0,87 (IC 0,82-0,91), por lo que la calibración fue adecuada y el modelo presentó una capacidad discriminativa moderada (Figura 1).
Discusión
Nuestro estudio evalúa la implicación de la infección por SARS-CoV-2 en tres aspectos diferentes de la patología hepática: la prevalencia de infecciones virales hepáticas subyacentes en pacientes con COVID19, la repercusión de dicha infección en la analítica hepática y la evolución clínica de los pacientes con enfermedad hepática previa e infección por SARS-CoV-2.
La infección por SARS-CoV-2 condiciona un riesgo de reactivación de infecciones virales subyacentes desconocidas, como son la hepatitis B, hepatitis C o la infección por VIH. Así las recomendaciones del Ministerio de Sanidad, en pacientes que ingresan por infección SARS-CoV-2 incluyen el cribado serológico de la infección por VHB, VHC y VIH. Con ello además, logramos un cribado oportunista de infección por VHC, pudiendo diagnosticar casos no conocidos en una población heterogénea tal y como indica el documento de posicionamiento de la Asociación Española para el Estudio de Hígado (AEEH)[7].
En nuestro estudio, pese a que estas recomendaciones se incluyen en la analítica de ingreso de los pacientes con infección por SARS-CoV-2, tan solo se ha realizado el cribado en la mitad de los pacientes.
La prevalencia en nuestra población con COVID19 de infección VHB es del 2.1%, prevalencia similar a la objetivada en un estudio que incluyó 1099 casos de pacientes con COVID-19 en China y mostró que 21 (2,1 %) tenían hepatitis B preexistente[8]. Los datos de la última encuesta de seroprevalencia de infección crónica por VHB en nuestro país sitúan la prevalencia de Ag HBs positivo en un 0,22%[9], cifra claramente inferior a la prevalencia de nuestra cohorte.
La prevalencia de infección activa por VHC estimada en población general es del 0,22% según los datos de la última encuesta de seroprevalencia llevada a cabo en España[9], cifra claramente inferior a la prevalencia de dicha infección en nuestra población de pacientes ingresados por infección por SARS-CoV-2 (1,3%).
La incidencia descrita en la literatura respecto a alteraciones en la bioquímica hepática en pacientes hospitalizados con COVID-19 oscila entre el 14 % y el 53%[10], siendo esta alteración más frecuente en pacientes con enfermedad hepática subyacente. En nuestro estudio, un 64% de los pacientes han presentado elevación de las transaminasas a lo largo de su ingreso hospitalario. En la mitad de ellos estas alteraciones ya estaban presentes en el momento del ingreso. No obstante, en estos casos, desconocemos si dicha alteración está relacionada con la infección por SARS-CoV-2 o con una patología hepática preexistente.
Aunque en la literatura se describe que aumento de las enzimas hepáticas se observa con más frecuencia en los casos más graves que en los más leves(10), la importancia pronóstica de la bioquímica alterada en COVID-19 sigue sin resolverse; algunos grupos han demostrado una fuerte correlación con la duración de la hospitalización, la insuficiencia orgánica y el ingreso en la unidad de cuidados intensivos, mientras que otros no han podido observar ninguna implicación clínica[11].
En nuestro estudio, la elevación de las transaminasas en pacientes con COVID19 se asocia con una menor mortalidad. Quizás la elevación de las transaminasas pueda estar relacionada en algunos casos con toxicidad hepática secundaria al uso de potentes fármacos inmunosupresores para tratar la infección por SARS-CoV-2, y ello podría explicar la menor mortalidad de este grupo. De hecho, los pacientes tratados con inmunosupresores en nuestra serie muestran cifras mayores de ALT. Así, el grupo de pacientes con transaminasas elevadas podría incluir un mayor número de pacientes tratados con inmunosupresores y ello explicaría su menor mortalidad.
Tal y como muestra nuestro estudio, los inmunosupresores se han relacionado con elevación de las transaminasas, y dado que estos fármacos, además de poder reactivar infecciones virales subyacentes, contribuyen en la toxicidad hepática, especialmente en pacientes con enfermedad hepática crónica[12], algunos trabajos desaconsejan su uso si los valores de AST y/o ALT superan cinco veces o más el límite alto de la normalidad[13].
Pese a que la cirrosis hepática es un estado de disfunción inmune que comprende inmunodeficiencia e inflamación sistémica, estudios realizados en diferentes cohortes sugieren que los pacientes con enfermedad hepática crónica no tienen un mayor riesgo de contraer la infección por SARS-CoV-2. La prevalencia de enfermedad hepática crónica subyacente en series de pacientes hospitalizados por COVID-19, está en torno al 0,6 y 1,4%[14], cifra similar a la de nuestro estudio. Sin embargo, la infección COVID19 aumenta el riesgo de descompensación de la enfermedad hepática crónica, incluso en ausencia de síntomas respiratorios. A ello se une la peor evolución clínica de la infección por SARS-CoV-2 con mayor morbimortalidad comunicada en pacientes con cirrosis hepática o con fibrosis avanzada[15],[16].
En nuestro estudio la evolución clínica y analítica de los pacientes con patología hepática previa fue similar al resto de pacientes, incluso en pacientes con cirrosis hepática. Ello probablemente esté en relación con el escaso número de pacientes cirróticos incluidos en el estudio.
La mayor limitación de nuestro estudio es probablemente el número de pacientes incluidos. Un mayor tamaño muestral habría permitido obtener datos más consistentes, fundamentalmente en relación al impacto de la patología hepática subyacente en la evolución de la infección por SARS-CoV-2 que requiere hospitalización. Otra de las limitaciones es la baja tasa de adherencia del cribado de infecciones VHC, VHB, y VIH que se ha realizado solo en un 50% de los pacientes ingresados con COVID-19, lo cual pone de manifiesto la necesidad de una mayor difusión entre los profesionales de las recomendaciones que pueden contribuir a aumentar la tasa de diagnóstico de la infección por VHC y VHB.
Para concluir, en primer lugar nuestro trabajo pone de manifiesto que la determinación de la infección VHB y VHC en los pacientes que ingresan por infección COVID19 es beneficioso en términos de estrategia de cribado, al ser esta una población con una prevalencia en ambas infecciones superior a la población general. Por otro lado, la alteración de la bioquímica hepática es frecuente y se relaciona con el uso de inmunosupresores. Son necesarios más estudios que permitan determinar con mayor consistencia la influencia de la infección viral subyacente en el COVID-19 así como su evolución en pacientes con enfermedad hepática preexistente.

 Descargar número completo
Descargar número completo Download full issue
Download full issue