CITA ESTE TRABAJO
Martínez Amate E, Porcel Martín A. Presente y futuro en el tratamiento del virus de la hepatitis B. RAPD Online. 2023;46(3):119-131. DOI: 10.37352/2023463.2
Introducción
La meta del tratamiento del virus B (VHB) es lograr la curación de la infección, algo que con los tratamientos disponibles hoy día, conseguimos en un pequeño porcentaje de pacientes (Tablas 1 y 2) .
Tabla 1
Resultados del tratamiento actual del VHB.
Tabla 2
Resultados del tratamiento actual del VHB.
Es por ello que, actualmente se aceptan en práctica clínica, otros objetivos secundarios como son: mejorar la supervivencia y la calidad de vida del paciente, impedir el desarrollo de enfermedad hepática y de carcinoma hepatocelular (CHC), evitar la transmisión vertical, la reactivación de la enfermedad, la recidiva tumoral, la progresión a insuficiencia hepática aguda así como evitar y tratar las manifestaciones extrahepáticas[1]-[3].
Para definir el objetivo final del tratamiento, en primer lugar, hay que partir del concepto de curación de la infección por el VHB. Con este objetivo, se celebró en Marzo de 2019 la conferencia de consenso entre la EASL (Asociación Europea para el Estudio del Hígado), la AASL (Asociación Americana para el Estudio del Hígado), la industria farmacéutica, las agencias reguladoras y los grupos de pacientes en la que se definieron distintos conceptos de curación del VHB y se fijaron los objetivos finales de los proyectos de investigación sobre nuevas terapias frente al VHB[4] . De dicha conferencia se extrajeron una serie de conceptos claves que se resumen en la tabla 3.
Tabla 3
Definiciones sobre "Cura de la hepatitis B".
Conceptos de curación del VHB
Cura esterilizante: se caracteriza porque todos los marcadores de infección son negativos, excepto el anti-Hbs si lo hubiese. Analíticamente es indistinguible de un paciente vacunado que no ha padecido la infección, ya que no existe ADNccc ni ADN integrado en el genoma por lo que no existe riesgo de reactivación viral. Tampoco existe riesgo de progresión de enfermedad hepática ni de carcinoma hepatocelular (CHC). Por todo ello, constituiría el objetivo terapéutico ideal, aunque supone un escenario difícil de alcanzar, al menos a corto plazo.
Curación funcional: definida por una pérdida sostenida del HbsAg (al menos dos determinaciones separadas por 6 meses) además del ADN indetectable del VHB 6 meses después del tratamiento. Este debe ser un objetivo alcanzable y común para la mayoría de las investigaciones puestas en marcha actualmente sobre nuevos tratamientos frente al VHB. Analíticamente se caracteriza por presencia o no de anti-Hbs y marcadores de infección negativos, excepto el ADN ccc y puede que el ADN integrado en el genoma del huésped, por tanto existe riesgo de reactivación, sin embargo, no existe riesgo de progresión de enfermedad hepática ni CHC. Esto es lo que ocurre en las personas que tienen una resolución espontánea de la infección.
Curación funcional "más realista" es aquella en la que vamos a tener un paciente con una hepatitis crónica pero que ha perdido el HbsAg con o sin positivización de los anti-Hbs. En este caso no existe replicación del virus, ni una enfermedad hepática activa, incluso la fibrosis si la hubiese , puede regresar con el tiempo, al igual que disminuye el riesgo de CHC con el tiempo, si no era cirrótico antes de comenzar con el tratamiento. Sin embargo, existe un daño hepático de base, por lo que existe riesgo, aunque bajo de desarrollo de enfermedad hepática y tumoral. Esto, con los tratamientos que disponemos en el presente, lo conseguimos sólo en un pequeño porcentaje de casos.
Curación "alcanzable" actualmente: es la que consiste en hacer el paciente con una hepatitis crónica B lo más parecido a lo que antes conocíamos como portador asintomático (infección crónica activa HbeAg-), con carga viral indetectable, y por tanto, con bajo riesgo de desarrollo de enfermedad hepática y de CHC pero con Hbs Ag+, con todo lo que ello conlleva. Este es un objetivo factible con los tratamientos actuales (Tabla 3) .
Tratamiento actual para el VHB.
Actualmente contamos con dos opciones terapéuticas para tratar el VHB: los análogos de los nucleót(s)idos y el interferón pegilado 2 alfa[1]-[3].
Ambos cuentan con una serie de ventajas e inconveniente (Tabla 4) , siendo considerados de primera elección los análogos de nucleót(s)idos por su cómoda posología, su aplicabilidad en grupos de riesgo y sus escasos efectos adversos, dentro de los cuales se recomiendan los de elevada barrera genética para evitar resistencias (tenofovir disoproxil fumarato (TDF), tenofovir alafenamida (TAF) y entecavir (ETV)).
Tabla 4
Ventajas e inconvenientes del PEG-interferón y los análogos de los nucleós/tidos.
Estos tratamientos han demostrado reducir la progresión hacia cirrosis, fallo hepático y CHC, sin embargo, cuentan con importantes limitaciones que han dado pie a continuas investigaciones en busca de alternativas mejores[1]-[4].
Limitaciones del tratamiento actual:
Eficacia limitada.
Las tasas de seroconversión a anti Hbe y pérdida de HbsAg en ambos tratamientos son más que mejorables, consiguiéndose seroconversión a anti-Hbe en los pacientes HbeAg+ tratados con INF durante un año, a los 6 meses de finalizar el tratamiento, en tan sólo un 32%, y un 3% de pérdida del HbsAg. En cuanto a los análogos, incluso los de alta barrera genética, encontramos resultados aún inferiores, con tasas de seroconversión del 10 al 21% y de curación funcional o pérdida del HbsAg del 1-3%. Resultados que empeoran aún más si se trata de pacientes HbeAg-, con tasas de pérdida del HbsAg del 4% para INF y del 0% para análogos, a pesar de conseguir estos últimos un excelente resultado en lo que a normalización de transaminasas y replicación viral se refiere (Tablas 1 y 2). Por tanto, podemos decir que ,con los tratamientos actuales, se consigue controlar la enfermedad, inhibiendo la replicación viral y logrando la seroconversión en algunos casos (objetivos intermedios) pero sin embargo, en muy pocos casos, se logra el objetivo principal del tratamiento, es decir, erradicar la infección.
Indicaciones de tratamiento discutidas.
Las guías de práctica clínica actuales tienen como objetivo común iniciar el tratamiento en pacientes con cirrosis o con enfermedad hepática activa ya sea HbeAg+ o negativo, pero en otros grupos de pacientes infectados, los beneficios del tratamiento aún no están claros y existen controversias entre las distintas sociedades[1]-[4]. Así por ejemplo, los pacientes con infección crónica por VHB Hbe Ag+ según la guía europea son candidatos a tratamiento si tienen más de 30 años y/o antecedentes familiares de CHC o cirrosis, siendo la guía americana algo más cauta, ya que recomienda tratamiento sólo si se demuestra daño hepático, puesto que este grupo de pacientes tienen un bajo riesgo de desarrollar cirrosis o CHC en un breve espacio de tiempo, y puede que espontáneamente su sistema inmune produzca una seroconversisón del Hbe Ag o incluso pierdan el HbsAg. Sin embargo, si existiera un tratamiento finito, sin efectos adversos y que consiguiera realmente curar la infección, con los beneficios que eso comporta en cuanto a transmisión y reducción de riesgos futuros, este grupo de pacientes, al igual que los portadores inactivos o con infección crónica por HbeAg-, en los que no está indicado tratamiento actualmente, podrían ser candidatos a tratamiento. Por tanto, el no disponer de una indicación universal de tratamiento como ocurre con otros virus como el virus de la hepatitis C (VHC), constituye en sí, otro límite del tratamiento.
Duración del tratamiento (¿cuándo parar?)
La decisión de suspender el tratamiento, viene dada o bien porque hemos alcanzado los objetivos prefijados o bien, por todo lo contrario, falta de eficacia y/ o la aparición de efectos adversos intolerables.
Así pues, podemos interrumpir el tratamiento si:
Conseguimos los objetivos prefijados:
- Pérdida del HbsAg sostenida con o sin creación de anti-Hbs (curación funcional).
Seroconversión a anti-Hbe (con consolidación de al menos 12 meses), en el caso de los HbeAg+ y no cirróticos.
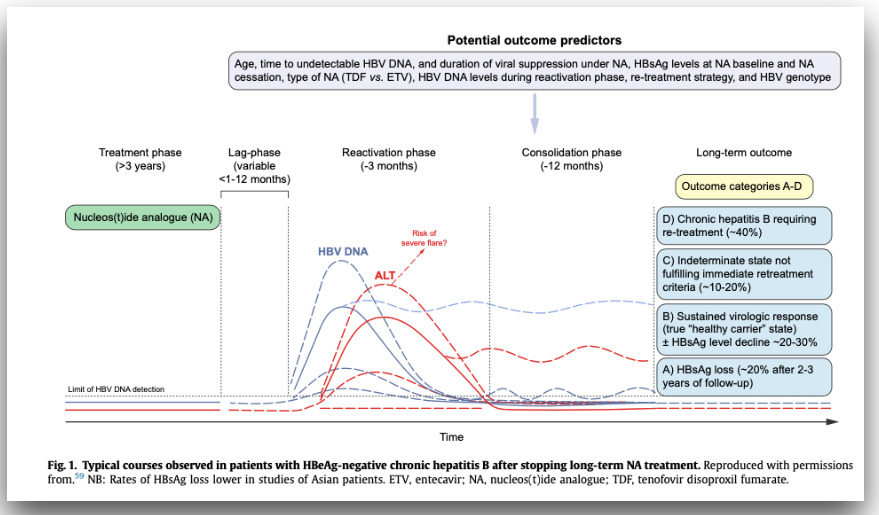
Respuesta virológica sostenida: en aquellos pacientes no cirróticos que consiguen una carga viral (CV) suprimida al menos de 3 años con los análogos disponibles actualmente. Esta es una de las reglas de parada más discutidas ya que la recaída virológica y clínica son comunes cuando se interrumpe el tratamiento, incluso entre pacientes que han presentado una CV indetectable durante años de tratamiento, como se puede observar en la figura 1, por lo que en pacientes de riesgo como son los pacientes cirróticos, no se recomienda esta estrategia, siendo pacientes en los que se acepta el tratamiento indefinido con análogos. Esto constituye una limitación muy importante del tratamiento actual, ya que se trata de dar un tratamiento de duración indefinida, asumiendo , además de la incomodidad para el paciente, riesgos que aunque bajos, no son desdeñables, para no conseguir eliminar la infección.
Se demuestra falta de eficacia o aparecen efectos adversos intolerables:
Falta de eficacia definida por una "no respuesta primaria, respuesta virológica parcial y el rebote virológico" que si hemos usado análogos de alta barrera genética, y el paciente se toma la medicación, es muy poco probable que se produzcan. De producirse, lo primero que se debe de hacer es comprobar la adherencia al tratamiento y si confirmamos ésta, investigaremos las probables resistencias siempre que se pueda y, sobre todo actuaremos tan pronto como sea posible, con un cambio de tratamiento.
Efectos adversos: En el caso del PEG-INF, este es su principal inconveniente, de hecho, un 5% deben suspender el tratamiento por intolerancia a los efectos colaterales y hasta en un 25% hay que reducir la dosis por los efectos secundarios.
Los análogos, en general, tienen pocos efectos adversos, pero de tenerlos, estos se producen fundamentalmente sobre la función renal u ósea.
Existen bajas tasas de deterioro de la función renal con ETV y TDF, aunque el potencial nefrotóxico es alto con TDF. Cuando se presentan generalmente requieren ajuste de dosis o cambios de tratamiento tanto a ETV como a TAF (éste último, aceptado en práctica clínica) cuya recomendación frente a TDF en pacientes de riesgo está ya recogida en las últimas guías de práctica clínica.
Por tanto, el tratamiento actual para el VHB es un tratamiento que en la mayoría de las ocasiones, no logra curar la infección, no podemos retirar sin asumir riesgos en la mayor parte de los pacientes y no está exento de efectos adversos, por lo que su indicación a largo plazo debía ser limitada. Esto ha motivado la búsqueda de nuevas estrategias de tratamiento basadas en un conocimiento más profundo del ciclo de replicación viral que salven estas limitaciones, las cuales, en su mayoría, se encuentran en fase de investigación.
Nuevas estrategias de tratamiento
Retirada del tratamiento.
En una infección crónica por VHB, el virus bloquea la respuesta adaptativa (linfocitos CD8) y la innata (células Natural Killer ). El sistema inmune por tanto, se vuelve ineficaz, como ya puso de manifiesto Bertoletti en 2012[5]. Con los análogos, bloqueamos la respuesta innata y con INF, la respuesta adaptativa. Esto ha motivado, la aparición de numerosos estudios en los que combinando ambas terapias secuencial o simultáneamente, se pretendía mejorar la respuesta al tratamiento, resultando todos ellos ineficaces en lo que a cambios en la práctica clínica se refiere[6],[7],[8].
No es hasta el estudio de Hadziyannis en 2012[9], que aparece la idea de suspender el tratamiento como una estrategia prometedora de curación funcional basada en la reactivación del sistema inmune, bloqueado por la infección crónica. Y a partir de ahí, surgen varios trabajos asiáticos y europeos[10]-[12] que concluyen en el trabajo de Lampertigo[13], en el que se observa qué ocurre con los pacientes tratados con análogos durante al menos 3 años y con respuesta sostenida a los que se les suspende el tratamiento. Como vemos en la Figura 1, al suspender el tratamiento, la primera fase "de lag" es aquella fase de latencia entre la suspensión del fármaco y la recidiva (de 1-12 meses) y que se ha visto que cuanto más corta es, más porcentaje de pacientes, aclaran el HbsAg. Esta fase va seguida de la fase de reactivación, en la que el sistema inmune se estimula y esto se traduce en una elevación de la carga viral y las transaminasas, es decir, se produce daño hepático, como en una hepatitis aguda, cuando el sistema inmune ataca a las células infectadas, con el fin de eliminar el virus. Éste constituye un punto crítico en el que se debe tomar la decisión de reintroducir tratamiento o esperar la respuesta del sistema inmunológico. Los resultados de este estudio, nos pueden alentar sobre qué decisión tomar, ya que se observó que si se sigue a estos pacientes durante aproximadamente 1 año (fase de consolidación), éstos se reparten en la siguiente proporción:
un 20% aproximadamente pierde el HbsAg, es decir, consiguen una curación funcional.
un 40% requieren nuevamente tratamiento porque desarrollan una hepatitis crónica (fracasan en esta estrategia).
entre un 10 y un 20% quedan en una zona indeterminada, en la que no pierden el HbsAg pero tampoco cumplen criterios de tratamiento, quizás la zona más preocupante, porque no está establecido aún qué estrategia seguir con ellos.
y por último, entre un 20-30% desarrollan una respuesta viral sostenida (RVS), son los verdaderos "portadores inactivos", que no pierden el HbsAg pero que sigue con CV baja.
Como podemos observar también en la Figura 1, se han propuesto varios posibles factores predictores de respuesta: la edad, la duración de la fase "lag", el nivel de HbsAg, duración de tratamiento previo, tipo de análogo utilizado y el genotipo entre otros. Sin embargo, la realidad es que ninguno de los estudios actuales identifica predictores de recidiva fuertes y fácilmente medibles que puedan identificar a los pacientes que tienen más probabilidades de lograr mayores tasas de curación funcional.
Otra cuestión importante es valorar el impacto que estos resultados han tenido en el diseño de nuevos estudios sobre moléculas dirigidas frente al VHB .Y es que si las tasas de curación funcional observadas en pacientes que han interrumpido el tratamiento con análogos sin adicción de ninguna otra molécula, se sitúan en torno al 20-25%, los objetivos finales de la mayoría de proyectos de investigación en marcha sobre nuevas alternativas terapéuticas parten de un objetivo deseable de tasa de curación funcional superior al obtenido con esta estrategia libre de fármacos. Y así queda reflejado en la conferencia de consenso de 2019 donde se fija como objetivo, tasas de curación funcional superiores al 30%[4].
Tabla 5
Indicaciones para elegir ETV o TAF frente a TDF.
Nuevos fármacos
En la actualidad, tal y como se refleja en las tablas 6 y 7, existen una serie de agentes en fase preclínica de investigación cuyo objetivo común es conseguir la curación funcional y se dividen en agentes dirigidos frente al virus y agentes dirigidos frente al sistema inmune del huésped[3],[14]-[16].
Tabla 6
Resumen de las nuevas terapias antivirales.
Tabla 7
Resumen de las nuevas terapias inmunomoduladoras frente al VHB.
Agentes dirigidos frente al virus
Estos agentes pueden actuar a distintos niveles:
1. En la entrada celular
Se ha visto que distintas moléculas utilizan el mismo receptor de entrada que el VHB y VHD: ciclosporina, ezetima y un nuevo fármaco aún en fase III para VHD y I y II para VHB, llamado Myrcludex B o Bulivertide un agonista del receptor NTCP que es el receptor de sales biliares del hepatocito por donde también entra el VHB y el VHD. Este fármaco ha demostrado reducir en suero los niveles de RNA e inducir la normalización de ALT en monoterapia[17].
En 2020 la Agencia Europea del Medicamento ha aprobado su indicación como tratamiento para la coinfección VHB-VHD[18], lo cual ha supuesto junto con la inclusión de TAF en la práctica clínica, uno de los mayores logros en cuanto a terapia antiviral frente al VHB en los últimos años.
2. Sobre el DNA ccc
ccc_R08 es un desestebalizador de cccDNA que está en fase preclínica. Se ha visto como en ratones, consigue una supresión sostenida de la carga viral y del HbsAg. Por otra parte, Cas 9 y CRISPR actúan sobre endonucleasas y han mostrado in vitro, como a través de una escisión en el cccDNA, logran una reducción del cccDNA y de otros parámetros de expresión viral
Otra diana terapéutica es la molécula HBx que se ha visto, es necesaria para la transcripción de ADNcc . Dos fármacos en experimentación actúan frente a esta molécula:
Contravir, que inhibe la formación del complejo Hbx-Ciclofilin y a partir de esto inhibe la replicación viral[19].
Nitazoxanide, que es un agente anti-infeccioso aprobado para enteritis por protozoos, que además inhibe la proteína Hbx , suprimiendo así la replicación viral y la producción de proteínas[20].
Otra diana terapéutica es la dirigida a silenciar la expresión del DNAccc, actuando en su paso a ARN mensajero y con el mismo resultado final, inhibición de la replicación viral. En un estudio de fase II, una dosis única de ARC-520 en combinación con entecavir resultó en un disminución profunda y duradera en el ADN del VHB en suero tanto en HBeAg positivo como en HBeAg negativo, así como una disminución en el nivel de HBsAg en HBeAg positivos.
3. Sobre la formación de la cápside
El primer compuesto estudiado en humanos fue el NVR 3-778 en un estudio fase Ib, observándose una disminución del ADN y el RNA del VHB sin embargo, la disminución del HbsAg sólo se objetivó cuando se combinó con PEG-IFN. Pero como vemos en la tabla 7, existen muchos CpAMs actualmente en fase de estudio clínica y preclínica.
4. Sobre la replicación viral
Dentro de los análogos de los nucleótidos y nucleósidos nuevos que ya conocemos y que actúan sobre la formación de nuevos viriones en el interior del hepatocito, destaca TAF (tenofovir alaflenamida), una realidad en las últimas guías de práctica clínica.
TAF es una nueva formulación de tenofovir que lo hace especial porque la mayoría llega al hepatocito y se elimina muy poco vía renal[21]. Esto hace que sus efectos adversos tanto renales como óseos sean menores que con los otros análogos, por tanto, está indicado fundamentalmente cuando aparecen efectos adversos o en pacientes de riesgo de daño renal y/u óseo (Tabla 5) .
5. Sobre el ensamblaje.
Otra diana terapéutica frente al virus la constituyen los agentes que impiden el ensamblaje de las moléculas de HbsAg. Éstas son polímeros de ácido nucleico (NAP).
Se han utilizado NAP diferentes (REP 2055, REP 2139, REP 2165) como monoterapia o en combinación con TDF o PEG-IFN (después del inicio con TDF) y se ha visto que inducen el aclaramiento de HBsAg y seroconversión anti-HBs en una alta proporción de pacientes con VHB crónica[22].
Agentes dirigidos frente al sistema inmune del huésped:
El tratamiento dirigido al sistema inmune o inmunoterapia, bien de novo o después de la supresión viral inducida por análogos, puede ser capaz de mantener la supresión virológica con bajos niveles de replicación de VHB bajo el control de la respuesta inmune del hospedador.
1. Interferón- Pegilado (IFN-PEG)
El IFN-PEG es una de las inmunoterapias con más experiencia en práctica clínica que, a pesar de ello, sigue siendo una de las más desconocidas. Su mecanismo de acción es complejo, ya que actúa por distintas vías: inhibe la encapsidación del virus con RNA, mejora la degradación de ADNccc, ejerce una modificación epigenética en la transcripción de DNA ccc y actúa sobre la expansión de las células NK que tienen una actividad antiviral. Todavía no se conocen bien los mecanismos de acción de IFN-alfa y el porqué tiene tasas más altas de respuesta en las infecciones de genotipo A y B. Los inconvenientes de IFN-alfa incluyen los efectos secundarios y la baja tasa de respuesta global que intentan ser salvados por las nuevas terapias inmunomoduladoras como los agonistas TLR.
2. Agonistas TLR y otros activadores de la inmunidad innata:
1. Vesotalimod es un fármaco que está en fase 2 y que es un agonista de los receptores TLR que podría mejorar la respuesta inmune, al igual que el INF pero sin los efectos adversos indeseados de éste. Los resultados que tenemos hasta la fecha son poco esperanzadores ya que se ha visto que no hay descenso en el nivel de antígeno. El estudio del que disponemos actualmente[23] es negativo y ahora se están planteando utilizarlo en pacientes naive, porque los 162 pacientes que se utilizaron para este estudio eran pacientes que ya habían recibido tratamiento con análogos.
2. Nivolumab, un fármaco aprobado como tratamiento del CHC como segunda línea y probablemente también como 1ª en un futuro próximo, es un fármaco que bloquea el receptor PD-1 de los hepatocitos, permitiendo una recuperación de la inmunidad de células T. Podría tener efecto sobre el virus B pero aún no hay datos[24].
3. Vacuna terapéutica.
El estudio publicado al respecto consistió en añadir esta vacuna para potenciar el sistema inmune a pacientes que estaban en tratamiento con análogos y sus resultados fueron poco esperanzadores. Después se ha probado con pacientes naive y tampoco ha mostrado resultados positivos[25].
4. Ingeniería de células B
Las células T capaces de reconocer las células infectadas por el VHB se han construido utilizando un receptor de antígeno quimérico (hecho de un anticuerpo anti-HBs específico) o utilizando receptores de células T específicos. Los resultados preliminares que utilizan estos enfoques son alentadores, con reducciones específicas de los hepatocitos infectados con VHB, el HBsAg y el ADN del VHB en modelos preclínicos. Se está investigando su uso en pacientes con CHC relacionado con el VHB[26].

 Descargar número completo
Descargar número completo Download full issue
Download full issue