CITA ESTE TRABAJO
Grilo Bensusan I. Alternativas terapéuticas a los inhibidores de bomba de protones (IBP) en la patología funcional esófago-gástrica. RAPD Online. 2023;46(3):132-144. DOI: 10.37352/2023463.3
Introducción
Enfermedad por reflujo gastroesofágico
En la enfermedad por reflujo gastroesofágico (ERGE) los inhibidores de la bomba de protones (IBP) constituyen la base de su tratamiento. Han demostrado ser más eficaces que el placebo y otros medicamentos para la remisión de los síntomas y para la curación de la esofagitis péptica[1],[2]. Sin embargo, los IBP no cumplen por completo todos los objetivos del tratamiento de la ERGE. Se describen fracasos en el tratamiento de la esofagitis grave (20-40%), en el tratamiento sintomático de la esofagitis no erosiva (mayor a un 40%), en los episodios de reflujo nocturno (mayor a un 38 %), en el tratamiento de mantenimiento (más de un 30 % de recidivas) y en la ERGE refractaria (mayor a un 40%). Tampoco existe una aprobación formal de su uso en el caso de las manifestaciones extraesofágicas y existen datos contradictorios en relación a su seguridad[2]-[4].
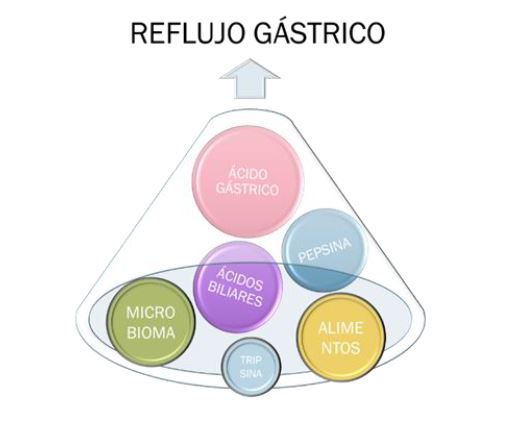
Además, el reflujo ácido sólo es un componente del complejo mecanismo fisiopatológico de la ERGE. A continuación, se enumeran otros elementos importantes en la patogenia de la ERGE, quedando fuera del objetivo de este trabajo un estudio profundo al respecto. En el contenido del reflujo también se encuentran la pepsina, los ácidos biliares, la tripsina, restos alimentarios e incluso bacterias que deben ser tenidos en cuenta (Figura 1) . La capacidad neutralizante de la saliva y del bicarbonato de las glándulas esofágicas tiene una misión protectora frente al ácido del reflujo. La exposición del esófago frente al contenido gastroduodenal aumenta la permeabilidad epitelial, con un aumento de los espacios intercelulares y estimulación de los receptores nerviosos que provocan los síntomas del reflujo. No hay que olvidar el concepto de "acid pocket" o remanente ácido gástrico, su tamaño y su relación con la hernia de hiato.
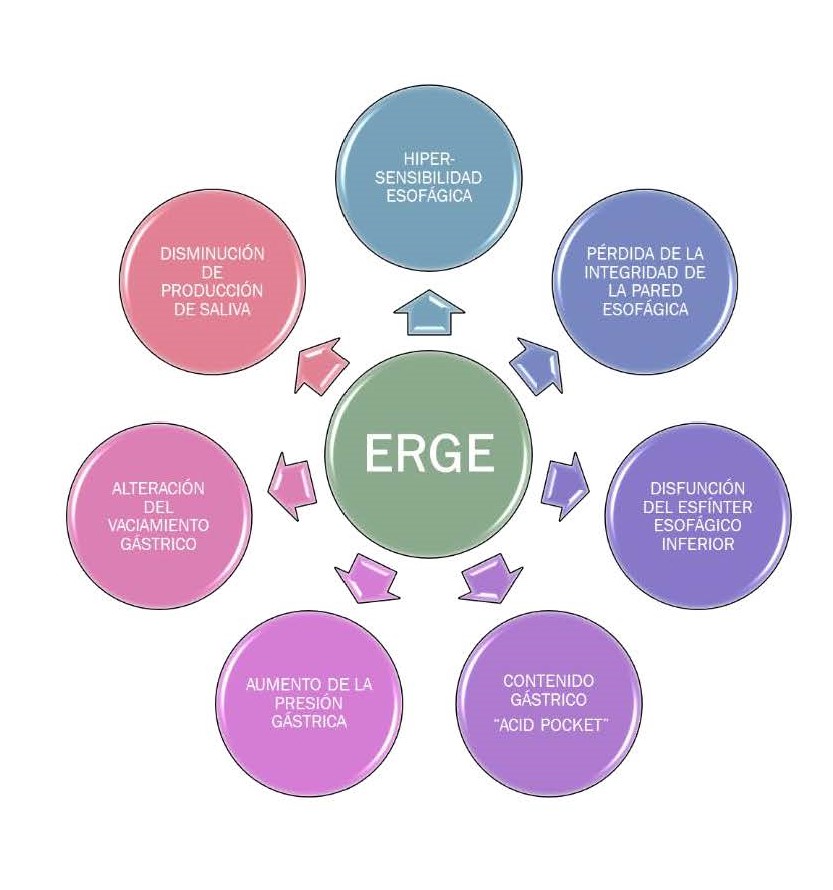
La función motora del esófago y del esfínter esofágico inferior, a través de las relajaciones transitorias de EEI y sus alteraciones en presencia de una hernia de hiato, juegan un papel fundamental en la patogenia de la ERGE. Las alteraciones en el vaciamiento gástrico y el aumento de la presión intragástrica también influyen en la patogenia de la ERGE[5],[6] (Figura 2).
En cada elemento de la fisiopatología existe una potencial diana terapéutica para la ERGE. A continuación, se presentan las alternativas a los IBP en relación con la fisiopatología de la ERGE.
Otros inhibidores de la secreción gástrica
Antagonistas de los receptores de la histamina H2 (Anti H2).
Hasta la aparición de los IBP eran los fármacos más usados[7]. Consiguen una disminución de la secreción ácida al bloquear los receptores H2 de la célula parietal gástrica. Son más eficaces que el placebo en el control de los síntomas y en la curación de la esofagitis, pero menos que los IBP.
Pertenecen a este grupo la ranitidina y la famotidina. Su posología en el caso de la famotidina es 20 mg/12h/voral (medio comprimido de 40mg) y de la ranitidina 150 mg/12h/voral. El aumento de dosis no mejora los resultados clínicos[1]. La venta de ranitidina fue suspendida en octubre de 2019 por la presencia de impurezas con nitrosaminas, no estando hoy en día disponible[8].
Según las recomendaciones actuales, está indicado su uso como tratamiento sintomático puntual para el alivio rápido de los síntomas, en pautas de tratamiento descendente para suspender los IBP y para el tratamiento del escape ácido nocturno, definido por ph-metría y que se asocie a la aparición de síntomas[1].
Bloqueadores de la ATPasa de la bomba de potasio.
Los bloqueadores de la ATPasa de bomba de potasio (P-CAB) constituyen un nuevo grupo de fármacos para la inhibición de la secreción ácida. Estos fármacos tienen una serie de diferencias frente a los IBP que los hacen atractivos para su uso en la ERGE. No necesitan activación en su forma activa y se concentran en mayor medida en el espacio ácido de la célula parietal. Se unen de manera competitiva y reversible, al sitio de unión del K en la bomba ATPasa K/H, tanto a las formas activas como inactivas de la misma. La duración del efecto depende de la vida media en el plasma. No dependen de las comidas ni de los polimorfismos del CP450 para conseguir su efecto y éste es completo desde la primera dosis[2],[7]. Además, alguno de ellos estimula la motilidad gástrica[2].
El vonoprazán es el fármaco más estudiado del grupo. Está comercializado en Japón desde el año 2015. Este fármaco ha demostrado ser más eficaz en la curación y en la prevención de la recurrencia de las esofagitis grados C y D de Los Ángeles. También mejora los síntomas más rápido que los IBP y especialmente en los pacientes con esofagitis y en los que no responden a IBP. Su perfil de seguridad es similar al de los IBP, observándose una elevación de los niveles de gastrina que no se han asociado a alteraciones en las células neuroendocrinas, ni en los niveles de pepsinógeno. También se ha observado un mayor riesgo de alteración de la microbiota intestinal con un aumento del riesgo de infecciones entéricas[2],[7]. En este caso las indicaciones aprobadas son el tratamiento de las úlceras gastroduodenales, la curación y prevención de la esofagitis erosiva, la gastroprotección en pacientes con toma de ácido acetil salicílico (AAS) y antiinflamatorios no esteroideos (AINEs) y la erradicación de H. pylori[2].
El tegoprazán está comercializado en Corea del Sur desde el año 2017. Este fármaco está aprobado para el tratamiento de la ERGE erosiva y no erosiva. Su eficacia para el tratamiento de la esofagitis péptica fue similar al uso de esomeprazol 40 mg durante 8 semanas y sin efectos secundarios relevantes. Este fármaco además del aumento del ph, es capaz de estimular la motilidad gástrica[2].
El revaprazán está comercializado en la India y en Corea del Sur desde el año 2007. Este fármaco tiene como particularidad respecto al anterior, su capacidad de gastroprotección mediante el aumento de producción de prostaglandina E2 y disminución de leucotrieno B4. También tiene un efecto antiinflamatorio mediante la regulación de enzimas proinflamatorias. Este efecto antiinflamatorio también es mayor en la gastritis por H. pylori. Por ello sus principales indicaciones son el tratamiento de la úlcera gastroduodenal y la gastritis. Sin embargo, no ha demostrado ser superior a los IBP en la ERGE[2].
Antiácidos
Los antiácidos neutralizan el ácido debido a su composición como bases de aluminio, magnesio o calcio. Se caracterizan por la rapidez de acción, pero la duración de su efecto es muy corta y no influyen en la curación de la esofagitis péptica. Se pueden usar como alivio sintomático en los casos leves o buscando un alivio rápido de los síntomas[1].
Medicamentos para la protección de la mucosa esofágica
Sucralfato
Es uno de los primeros fármacos comercializados como protector de la mucosa. Se estudió fundamentalmente para la curación de la úlcera péptica por su propiedad para adherirse a la superficie de las úlceras, pero también por su capacidad para la estimulación de la producción de moco y bicarbonato y de la reparación y crecimiento de los tejidos.
En la ERGE ha demostrado su eficacia frente a placebo en el control de los síntomas en la ERGE no erosiva, y en una mejor cicatrización con menor riesgo de estenosis en los casos de esofagitis severa[7].
Alginatos
Los alginatos tienen la capacidad de formar un gel en contacto con el ácido del estómago de manera que forman una barrera mecánica que cubre el ácido postprandial del estómago proximal, también conocido como "acid pocket". Este es mayor en los pacientes con ERGE, hernia de hiato y tras la ingesta de comidas grasas y picantes. También es capaz de limitar el reflujo de otros componentes del reflujo gastroesofágico[7],.
En un reciente metaanálisis, han demostrado su mayor eficacia frente al placebo o antiácidos en el control de los síntomas de la ERGE y similar a antiH2 e IBP[9]. Su uso asociado con los IBP logra un mayor éxito terapéutico y pueden ser usados en el tratamiento de mantenimiento[10].
Ácido hialurónico y condroitín sulfato
El mecanismo de acción de este fármaco es múltiple. El ácido hialurónico y el condroitín sulfato tienen una función antiinflamatoria, antioxidante, inmunomoduladora y estimulante de la reparación de las heridas y la regeneración tisular. También tiene la capacidad de unirse e inactivar a la pepsina. Este fármaco añade un elemento en su composición que favorece su permanencia en la mucosa esofágica durante más tiempo.
En relación con los estudios realizados, su eficacia en el control de los síntomas es mayor a placebo tanto en la ERGE erosiva como no erosiva y su asociación a IBP aumenta la resolución de los síntomas de la ERGE. El tratamiento es bien tolerado, no presenta efectos adversos y se puede usar a largo plazo[7],[10].
Rebamipida
La rebamipida es un fármaco comercializado en algunos países del sudeste asiático para el tratamiento de la enfermedad por reflujo. Su mecanismo de acción se basa en la estimulación de la secreción de prostaglandinas, la expresión del factor de crecimiento epidérmico y el secuestro de sustancias oxidativas.
Sin embargo, su uso frente a placebo, no ha mejorado la sintomatología en los pacientes en los que ha fracasado el tratamiento con IBP[2].
Inhibidores del reflujo
Las relajaciones transitorias del esfínter esofágico inferior forman parte fundamental en el proceso fisiopatológico de la ERGE. Por ello, suponen una diana terapéutica interesante y alternativa al uso de los IBP[1],[6],[7].
Baclofeno
Es un fármaco agonista tipo b del receptor GABA que produce una inhibición de las relajaciones transitorias del EEI y aumento del tono de reposo del EEI. Un metaanálisis con 283 pacientes frente a placebo demostró en el corto plazo una reducción del número de episodios de reflujo y de la duración de estos. Sin embargo, no se acompañaban de una mejoría sintomática y se asociaba a la aparición de efectos secundarios. Los efectos secundarios más frecuentes son el mareo, la confusión, el dolor de cabeza, la hipotonía, las náuseas y los vómitos. Estos efectos secundarios no fueron significativamente superiores al placebo en dicho metaanálisis. Sin embargo, por su uso en otras indicaciones, se conoce que suponen una limitación en su uso, por mala tolerabilidad del paciente[1],[7].
Otros inhibidores
Intentando minimizar los efectos secundarios del baclofeno se están investigando otras moléculas. Una de ellas es el arbaclofeno. Este fármaco no ha demostrado en estudios en fase 3 una reducción de los episodios de reflujo frente a placebo, aunque los efectos secundarios no supusieron una suspensión significativa del fármaco. Otro de ellos es el lesogaberán, pero en estudios en fase 2 no ha demostrado una diferencia significativa en la mejoría de los síntomas y se ha descrito algunos casos de hepatotoxicidad reversible[1],[7].
Por lo tanto, los inhibidores del reflujo, representados por el único inhibidor del receptor GABA tipo b en el mercado, que es el baclofeno, no suponen una alternativa tan prometedora como se esperaba desde el punto de vista fisiopatológico. Podría plantearse su uso en pacientes que no responden a la terapia con IBP, especialmente en caso de reflujo no ácido y de gas, que se hayan confirmado mediante impedanciometría intraluminal multicanal asociada al estudio del pH y vigilando la aparición de efectos secundarios. [1],[7] La dosis recomendada de inicio es de 5 mg/8h/voral, pudiéndose aumentar a los 3 días de manera progresiva hasta alcanzar una dosis de 30 mg/día.
Procinéticos
Los procinéticos no tienen una evidencia de calidad para su uso en la ERGE. Un metaanálisis demostró cierto beneficio en la sintomatología asociados con IBP, sin aumentar la curación de la esofagitis.
Según la guía de práctica clínica española estos fármacos se recomiendan en caso de enlentecimiento demostrado del vaciamiento gástrico o en caso de que se asocie una dispepsia tipo distrés posprandial. En las guías clínicas estadounidenses de 2018 no se incluyen estos fármacos como alternativa y en las japonesas tan sólo si fracasan el resto de los fármacos e incluso la cirugía[1],[7].
Neuromoduladores
Los neuromoduladores reducen la hipersensibilidad visceral mediante efectos sobre las vías nociceptivas del sistema nervioso central y en menor grado, modulando la hiperalgesia periférica.
Los fármacos más usados son los antidepresivos, incluyendo en este grupo los antidepresivos tricíclicos, los inhibidores de la recaptación de serotonina, los inhibidores de la recaptación de noradrenalina y serotonina y la trazodona. También se ha usado la melatonina.
A pesar de ser fármacos con escasos estudios que evalúen su eficacia, se consideran de primera línea en el tratamiento de la pirosis funcional. También podrían tener un papel en la hipersensibilidad por reflujo y en la ERGE refractaria a IBP.
En muchas ocasiones los efectos secundarios limitan su uso, por ello se recomienda comenzar con dosis bajas e ir aumentándolas lentamente. También es recomendable usar en una dosis nocturna antes de acostarse, ya que suelen provocar somnolencia. No existen estudios comparativos que apoyen el uso de un grupo de fármacos frente a otro[11]-[13].
Dispepsia funcional
La dispepsia funcional (DF) afecta entre un 5-20% de la población mundial. Se caracteriza por la existencia de síntomas crónicos o recurrentes de dolor epigástrico y/o saciedad precoz y plenitud postprandial cumpliendo los criterios de Roma IV. La DF se clasifica en subtipo dolor epigástrico o subtipo distrés posprandial, pudiendo coexistir ambas en el mismo paciente. Aunque no es un proceso que suponga un riesgo vital para los pacientes, tiene un impacto importante en su calidad de vida, en su productividad laboral y supone importantes gastos sanitarios. Hoy en día se diferencia de la dispepsia asociada a H. pylori, que no se aborda en este trabajo[14],[15].
Tabla 1
Alternativas a los IBP en la ERGE según grupo farmacológico. * Suspendida la comercialización. + No comercializado en España # Comercializada en España a dosis inferiores a 2 gr.
El uso de IBP se propone como tratamiento empírico en los pacientes con sospecha de DF, en los países con baja prevalencia de H. pylori o en los países con alta prevalencia en los que se ha descartado dicha infección. Su efectividad, a dosis estándar o a dosis altas, es superior al placebo, siendo algo más efectivo en el subtipo dolor epigástrico. Sin embargo, la respuesta sintomática se obtiene entre un 30-70% de los pacientes, por lo que en este proceso es necesario conocer alternativas terapéuticas para intentar obtener mejores tasas de respuesta sintomática. Además el mecanismo por el cual la supresión ácida influye en la función gástrica y mejora los síntomas en la DF es desconocida, aunque se podría asociar a una alteración en el aclaramiento del ácido gástrico a nivel duodenal y a una mayor sensibilidad de éste al ácido[14],[16].
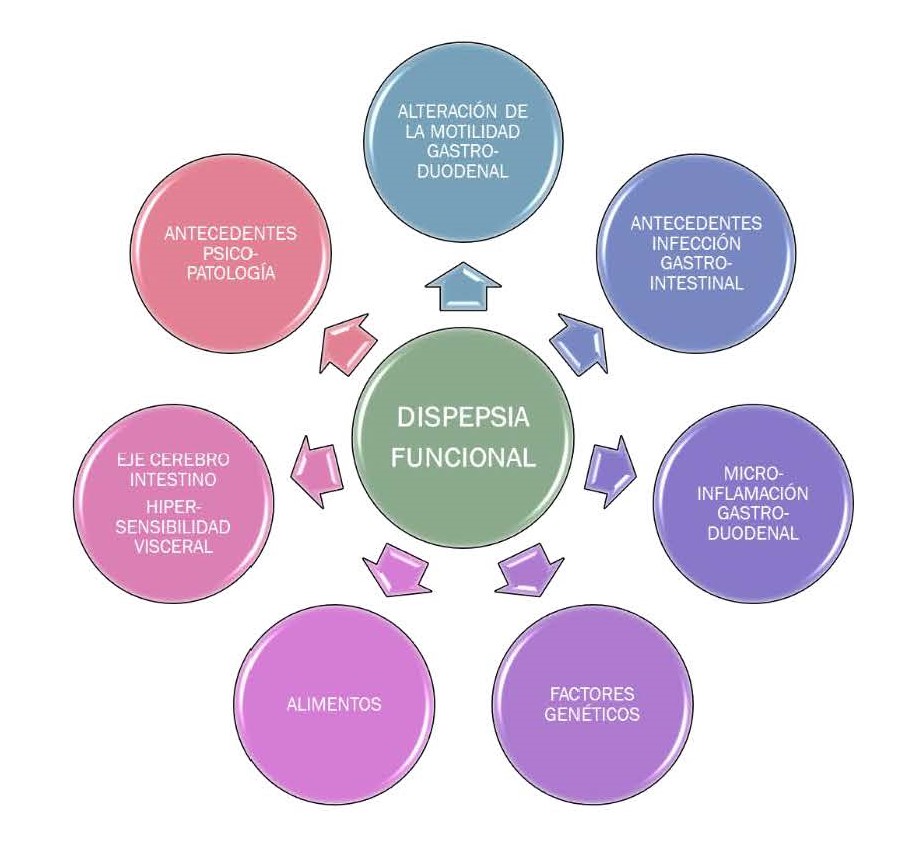
La patogenia de la DF es realmente compleja y sólo parcialmente conocida. Se entiende como la concurrencia de múltiples factores que conllevan a la aparición de los síntomas (Figura 3) .
Uno de los más estudiados es la alteración de la motilidad gastroduodenal. Alteraciones en el vaciamiento gástrico se observan en un tercio de los casos y la inadecuada acomodación del estómago en un 40 % de los casos.
El antecedente de una infección gastrointestinal está presente en un 15 % de los casos de DF, especialmente si además concurren trastornos psicológicos en el paciente. La microinflamación duodenal también podría tener un papel en la fisiopatología.
Como en el resto de los trastornos funcionales digestivos, se conoce que el eje cerebro-intestino juega un papel importante. Este término hace referencia a las relaciones existentes entre el cerebro y el intestino a través del sistema nervioso central y el plexo mientérico. La ansiedad y la depresión se asocian claramente a la DF, presentando síntomas más intensos, peor calidad de vida y mayor uso de recursos médicos.
Recientemente se asocia la DF a factores genéticos. Sin embargo, es improbable que la patogenia de la DF se explique con una sola alteración genética.
Con respecto a la alimentación existen escasos estudios en la DF. Las comidas grasas, el consumo de cafeína y los FODMAPs podrían estar relacionados con la DF tipo distrés postprandial[15].
Otros inhibidores de la secreción gástrica.
Antagonistas de los receptores de la histamina H2 (Anti H2).
Los AntiH2 han demostrado su eficacia frente a placebo según recientes metaanálisis, y según una revisión Cochrane su efectividad es similar a los IBP[17],[18]. Por lo tanto, aunque se usen más frecuentemente los IBP en la DF, los antiH2 pueden ser una alternativa válida a dichos fármacos[15].
Bloqueadores de la ATPasa de la bomba de potasio.
Como se indicó previamente, el vonoprazán es el fármaco más estudiado del grupo. Tan sólo existe un estudio en la DF en la que el uso de este fármaco mejoraba los síntomas en un 42 % de los pacientes que no respondían a IBP. El tegoprazán tiene la capacidad para estimular la motilidad gástrica por lo que sería un miembro del grupo con mejor perfil para la DF, pero no existen publicaciones en este sentido[2],[14]. Serán necesarios más estudios para afinar la indicación de esta familia de fármacos en este grupo de pacientes.
Procinéticos
En la fisiopatología de la DF se incluye la falta de acomodación del fundus o el retraso del vaciamiento gástrico, por lo que los procinéticos constituyen una opción de potencial eficacia en su tratamiento. De hecho, los procinéticos son más efectivos que el placebo con un margen de un 14 % sobre el mismo[14]. Sin embargo, la existencia de efectos secundarios y una disponibilidad poco homogénea a nivel mundial de los mismos reduce las posibilidades de uso.
Antagonistas del receptor de la dopamina 2.
Metoclopramida
La metoclopramida es un antagonista del receptor de la dopamina, que también tiene acción agonista sobre el receptor 5-HT 4. Dada su capacidad para atravesar la barrera hematoencefálica produce efectos neurológicos centrales. A pesar de que los estudios demuestran una mejoría de los síntomas con respecto a placebo, dichos efectos limitan su uso prolongado en el tiempo y han provocado que no se realicen nuevos estudios con el mismo[14],[15].
Existe una nota de la Agencia Española del Medicamento y Productos Sanitarios (AEMPS), en la cual se indica que su uso debe restringirse a pacientes adultos para la prevención y tratamiento de náuseas y vómitos inducidos por quimioterapia (retardados), radioterapia, cirugía y por migraña. Además, se debe limitar la duración del tratamiento a un máximo de 5 días. Por lo tanto, no está indicado su uso en la DF[19].
Domperidona
La domperidona también pertenece al grupo de los antagonistas del receptor de la dopamina y ha demostrado su capacidad para mejorar los síntomas en la DF frente a placebo[14].
Sin embargo, en este caso sus efectos secundarios cardiológicos, con prolongación del intervalo QT, también ha provocado que no esté indicado su uso en la DF. Existe una nota de la AEMPS especificando sus indicaciones concretas[20].
Itoprida
La itoprida sólo está comercializada en Asia y en algunos países europeos. Se trata de un fármaco más seguro que los previos, ya que no atraviesa la barrera hematoencefálica y no se han descrito alteraciones cardiológicas. Mejora los síntomas en los pacientes con DF, siendo mejores los resultados que la domperidona, especialmente en el grupo en el que coexisten el síndrome de dolor epigástrico y el distrés postprandial[14].
Cinitaprida
Es un fármaco que además de su función antagonista de los receptores de dopamina 2, es un antagonista de los receptores 5-HT2 y agonista de los 5-HT4.
Está comercializado en España desde el año 1990, sin embargo, tiene menos estudios de eficacia en la DF, ya que no está comercializado en muchos países. En dos estudios se demostró una mejora en los síntomas y en la calidad de vida de los pacientes con DF. Recientemente en un metaanálisis en red; un tipo de estudio que intenta comparar la eficacia de diferentes tratamientos para una patología, que no se han comparado directamente entre sí en los estudios originales; la cinitaprida era el segundo fármaco con mejor respuesta sintomática en la DF, por detrás de la levosulpirida[14],[21]-[24].
El uso de cinitaprida, a diferencia de otros inhibidores de los receptores de la dopamina 2, no se ha asociado a alteraciones cardiológicas. Como efectos secundarios puede aparecer ginecomastia, galactorrea, somnolencia y extrapiramidalismo, que se resuelven con la reducción o suspensión del fármaco[22].
Levosulpirida
La levosulpirida es un enantiómero de la sulpirida que además de la acción antagonista de los receptores de dopamina tipo 2, es agonista de los receptores 5-HT 4. A través de estos receptores provoca un aumento de la actividad motora del tracto gastrointestinal favoreciendo el vaciamiento gástrico y de la vesícula biliar. También parece reducir la sensibilidad del estómago en la DF[25].
Está disponible en el España desde el año 2001, pero al igual que la cinitaprida, su disponibilidad está limitada a algunos países. Por ello, tampoco tiene estudios amplios ni se aborda su utilidad en la literatura anglosajona[14],[15]. Sin embargo, existen trabajos que demuestran su eficacia en la DF frente a placebo, mejorando los síntomas y la calidad de vida. En estudios comparativos frente a metoclopramida, domperidona y cisaprida se muestra superior a ellos[22],. [22],[25].[26] En este sentido, en un reciente metaanálisis en red comentado previamente, la levosulpirida es considerada como el tratamiento con mayor probabilidad de eficacia frente al resto de tratamientos propuestos en la DF[21].
La dosis recomendada es de 25mg por vía oral, 3 veces al día, al menos 20 minutos antes de las comidas. Se usa en periodos de 4 a 8 semanas sin recomendarse su uso de manera permanente. Con respecto al perfil de seguridad, la levosulpirida en base a la publicación de dos artículos se considera un fármaco de riesgo para la prolongación de intervalo QT y de arritmia tipo "Torsades de Pointes"[27],[28]. También se asocia a la aparición de tensión mamaria, ginecomastia o galactorrea, que son debidos a un incremento en la concentración de prolactina y que desaparecen al suspender la medicación[25].
Cleboprida
Además de la función antagonista de los receptores tipo 2 de la dopamina, también es antagonista de los 5HT-3 y agonista de los 5HT-4. Tan sólo en un estudio frente a placebo, la cleboprida a dosis de 500 mcg/8h/voral demostró disminución de los síntomas con escasos efectos adversos[14].
Agonistas del receptor de la serotonina tipo 4. 5HT-4.
Mosaprida
La mosaprida es un procinético que está comercializado en muchos países asiáticos. En un estudio japonés demuestra una mejoría sintomática de los pacientes son DF y un metaanálisis comparándolo con antagonistas de los receptores de la dopamina encuentra una respuesta sintomática superior a dichos fármacos. Sin embargo, un estudio europeo no demostró superioridad de la mosaprida frente a placebo en la DF[14].
Tegaserod
El tegaserod se indicó como tratamiento para el estreñimiento funcional y el síndrome de intestino irritable con predominio de estreñimiento. Tras suspenderse su comercialización en EE. UU. se ha reintroducido para su uso en mujeres menores de 65 años. Su papel en la DF parece marginal ya que los estudios realizados señalan una discreta mejoría de los síntomas con relación al placebo[14]. En cualquier caso, el fármaco no está comercializado en España.
Prucaloprida
Se trata de un potente agonista del receptor 5-HT4 que se usa en el estreñimiento crónico. Sin embargo, su efecto estimulante de la motilidad gástrica ha hecho que se use en la gastroparesia y que pudiera ser un candidato para el tratamiento de la DF tipo distrés postprandial[15].
Otros procinéticos
Acotiamida
La acotiamida es un antagonista de los receptores muscarínicos presinápticos. Se ha desarrollado y está comercializado en Japón y la India. Su efecto se asocia a una mejoría de la acomodación gástrica y del vaciamiento gástrico. Por ello, se observa una disminución de los síntomas en los casos de distrés postprandial, siendo contradictorios los resultados entre los pacientes con síndrome de dolor epigástrico. No se refieren efectos secundarios importantes, señalándose entre ellos la diarrea, la cefalea y un incremento en los niveles de prolactina. Están en marcha nuevos estudios que podrían facilitar su comercialización en Europa[14],[15].
Buspirona
La buspirona es un fármaco que se usa para el trastorno de ansiedad generalizado. En un estudio demostró una mejoría de la acomodación gástrica y del vaciamiento gástrico de líquidos. Estos efectos eran independientes del estado de ansiedad del paciente. Por ello se propone su uso en la DF tipo distrés postprandial. El medicamento se dejó de comercializar en España[15].
Cisaprida
La cisaprida ha sido el procinético más estudiado en la dispepsia funcional y mostraba una capacidad importante para la mejoría de la dispepsia funcional con un NNT de 7. Su efecto se basaba en una acción agonista 5-HT4 y antagonista 5-HT3. Sin embargo, su asociación a efectos cardíacos severos llevó a la suspensión de su comercialización en España desde el 1 de enero de 2005[15].
Neuromoduladores
Los neuromoduladores interrumpen o modulan la interpretación del sistema nervioso central de la información recibida a través del sistema nervioso mientérico. Son de especial utilidad en caso de existir trastornos psiquiátricos concomitantes, otros trastornos funcionales digestivos u otros trastornos psicosomáticos. Si bien, su efecto es independiente de su acción sobre la comorbilidad psicológica. Aunque se usan ampliamente en la clínica no existen estudios tan amplios en la DF como en otros trastornos funcionales digestivos, como el síndrome de intestino irritable.
Los antidepresivos tricíclicos son los fármacos más estudiados en la DF. Concretamente, la amitriptilina mejora los síntomas de la DF especialmente en el subgrupo del tipo dolor epigástrico. Su mecanismo de acción no está aclarado. Como se comentó previamente, las dosis usadas son menores a las necesarias en la depresión, y se recomienda usar dosis bajas de inicio, por la noche antes de acostarse y subirlas lenta y progresivamente. Entre los efectos secundarios se encuentra la somnolencia, la boca seca, la retención urinaria, el mareo y la disfunción sexual. Una revisión sistemática establece un NNT (número necesario para tratar) de 6 en el tratamiento con antidepresivos tricíclicos en la DF[14],[15].
La mirtazapina es un antidepresivo tricíclico pero que además tiene acciones sobre receptores adrenérgicos y serotoninérgicos. En un pequeño ensayo la mirtazapina mejoró la calidad de vida, la plenitud precoz y la pérdida de peso en pacientes con DF. Las dosis usadas de inicio son de 15 mg/día [14],[15].
A diferencia de patología funcional del esófago, los inhibidores selectivos de la recaptación de serotonina y los de la recaptación de la noradrenalina, no han demostrado ser eficaces en la DF[14],[15].
También hay que hacer referencia a que las benzodiacepinas no han sido estudiadas en monoterapia en la DF. Por ello, dados sus efectos secundarios no está recomendado su uso en este proceso, salvo para el tratamiento de un cuadro de ansiedad que coexista con el cuadro de DF[29].
Antibióticos y probióticos
El uso de prebióticos, probióticos y simbióticos también se ha explorado en la DF. Sin embargo, los estudios aleatorizados y controlados frente a placebo son escasos. De hecho, en un reciente metaanálisis se sugiere un efecto beneficioso de los probióticos en la DF, pero tan sólo se incluyeron 5 estudios aleatorizados. Este estudio tampoco fue capaz de identificar una cepa superior a otra y se sugiere que la mejoría es superior cuando se asocian probióticos y prebióticos. Sin duda, dado el interés actual en el estudio de la microbiota y de los pre, pro y simbióticos se pondrán en marcha nuevos estudios para aclarar la utilidad de estos en la DF[15],[30].
Con respecto a los antibióticos, la rifaximina ha sido estudiada en un ensayo controlado en la DF con resultados favorables en la mejoría de los síntomas dispépticos y la plenitud postprandial, especialmente en mujeres. La dosis usada fue de 400 mg/12h durante 14 días[15].
Fitoterapia
La DF es una patología en la que la medicina alternativa y complementaria suele ser atractiva para los pacientes que la sufren. En muchas ocasiones, recurren a dichos productos en base a su uso tradicional para los trastornos gastrointestinales. Cómo se ha visto previamente el resultado de los fármacos usados en la DF dista mucho de ser satisfactoria. Por estos motivos, en los últimos años se está prestando un especial interés en la investigación de estos productos, que ofrecen como ventajas su buena tolerancia y su acción a diferentes niveles.
Aceite de menta piperita y alcaravea
El aceite de menta piperita tiene una actividad antagonista de los canales de calcio y en sujetos sanos ha demostrado una disminución de la presión intragástrica y de la motilidad duodenal. Está comercializado en España e indicado fundamentalmente en el síndrome de intestino irritable. No se ha estudiado aisladamente en la DF[14],[31].
El aceite de alcaravea tiene acciones sinérgicas con el aceite de menta piperita. Por ello se ha investigado una combinación de ambos, a dosis fijas, demostrando una mejoría de la distensión abdominal y del dolor epigástrico frente a placebo. Esta combinación no está comercializada en España[14],[31].
Iberogast (STW-5)
Se trata de una combinación de extractos de 9 plantas diferentes que provocan una relajación del fundus y una mayor contractilidad antral que podría explicar su efecto. El mecanismo sugerido para esta actividad se ha asociado a una acción agonista de receptores de 5-HT-4 y menor medida, sobre receptores muscarínicos y opioides. Diferentes estudios han demostrado su eficacia frente a placebo y similar a cisaprida. Los efectos comienzan a ser evidentes a partir de 2 semanas de tratamiento. Su uso se considera seguro y es bien tolerado. Está comercializado en España[14],[31].
Rikkunshito
En este caso se trata de una combinación de extractos de 8 plantas diferentes que se usa en Japón. El mecanismo de acción se asocia a una mejoría de la función gástrica mediada por la liberación de grelina y una menor inactivación de esta. El uso de este producto mejoró los síntomas de la DF frente a placebo, aunque en algún estudio no alcanzó diferencia estadísticamente significativa[14],[31].
Otros
El regaliz es otra sustancia que se sugiere como potencialmente efectiva en la DF. Así un preparado denominado GutGard ® demostró en un pequeño estudio con 50 pacientes ser más eficaz que el placebo en la mejoría de los síntomas de la DF[31].
El jengibre ha demostrado mejorar el vaciamiento gástrico, pero en los pocos estudios realizados no ha mejorado la sintomatología en la DF[31].
Tabla 2
Alternativas terapéuticas a los IBP en la dispepsia funcional.
Tratamientos no farmacológicos
Los estudios acerca de la eficacia de la acupuntura en la DF no ofrecen una evidencia clara al respecto.
En un estudio comparativo con cisaprida, la hipnosis demostró una mayor eficacia estadísticamente significativa en el vaciamiento gástrico.
Los estudios con respecto a la psicoterapia y la DF son escasos, pero parece que asociación de la psicoterapia con el tratamiento médico convencional mejora los síntomas y la calidad de vida en los pacientes con DF[14],[31].
Conclusión
Los IBP cambiaron drásticamente el abordaje y la respuesta al tratamiento en la ERGE. Sin embargo, la respuesta terapéutica no siempre es satisfactoria. En la DF los IBP no juegan un papel tan determinante como en la ERGE, aunque se consideran de primera línea en el tratamiento empírico. El conocimiento de la fisiopatología permite comprender cómo existen otros fármacos que son importantes para alcanzar el objetivo terapéutico deseado. La información presentada en esta revisión ofrece una posibilidad para ampliar el arsenal terapéutico de cada facultativo para mejorar la atención de estos pacientes.

 Descargar número completo
Descargar número completo Download full issue
Download full issue