CITA ESTE TRABAJO
Rodríguez Sicilia MJ. Métodos diagnósticos de la infección por Helicobacter pylori. RAPD Online. 2023;46(3):145-154. DOI: 10.37352/2023463.4
Introducción
El Helicobacter pylori (H. pylori) es el agente causal de la infección crónica bacteriana más prevalente, se cree que afecta a más de la mitad de la población mundial y se asocia a varias afecciones gástricas como enfermedad ulcerosa péptica, gastritis crónica, adenocarcinoma gástrico y linfoma MALT gástrico. Es el factor de riesgo conocido más fuertemente asociado al desarrollo de cáncer gástrico, siendo el agente causal más común de cáncer asociado a infección y responsable del 5.5% de todos los cánceres a nivel mundial. Puesto que es un patógeno con elevada prevalencia a nivel mundial y capaz de producir una conmorbilidad significativa, es esencial realizar el diagnóstico correcto y un tratamiento eficaz con la finalidad de prevenir el desarrollo de complicaciones posteriores. En la actualidad, el H. pylori presenta una creciente resistencia a pautas de tratamiento que antes eran eficaces tanto en áreas de alta como de baja prevalencia de la infección, lo que confiere gran importancia a la realización de test para comprobar la curación de la infección tras el tratamiento.
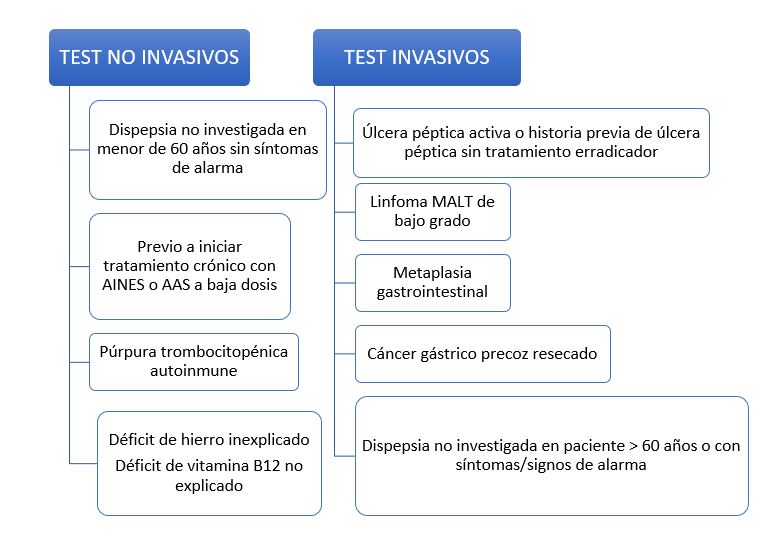
Se debería ofrecer tratamiento erradicador para infección por H. pylori a todos los pacientes con una prueba diagnóstica positiva para infección activa por H. pylori, por lo que la determinación de la infección debería realizarse sólo si se tiene intención de realizar tratamiento erradicador si el resultado del test es positivo. En este sentido, el V Consenso de Maastrich y la guía del American College of Gastroenterology (ACG) 2017, establecen una serie de situaciones en las que está indicado el diagnóstico de la infección por H. pylori. Entre ellas se encuentran por ejemplo la enfermedad ulcerosa péptica, el cáncer gástrico precoz, el linfoma gástrico tipo MALT en estadio localizado y la dispepsia no investigada en paciente menores de 60 años en ausencia de signos y síntomas de alarma. En los pacientes con dispepsia que cumplen dichos criterios, se puede aplicar la estrategia "test and treat".
Clasificación de los test diagnósticos de la infección por H. pylori
Clásicamente, los test diagnósticos se han clasificado en invasivos o no invasivos dependiendo de si se requieren realización de gastroscopia o no respectivamente. No existe consenso oficial acerca del método óptimo para el diagnóstico de la infección por H. pylori. Por lo que la elección del test dependerá de si el paciente requiere o no realización de gastroscopia para evaluar los síntomas o para seguimiento de patologías que así lo requieran, como la úlcera gástrica o el linfoma MALT. Por ello, la endoscopia no debe indicarse únicamente con el propósito de diagnosticar la infección por Helicobacter pylori (Figura 1).
Figura 1
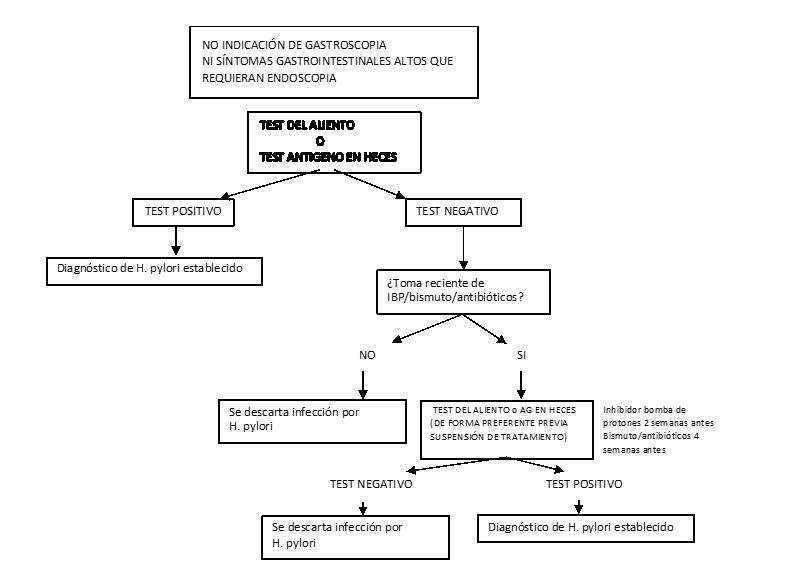
Manejo de los test diagnósticos no invasivos en el diagnóstico de la infección por H. pylori. Gráfico adaptado de Sheila E Crow. UpToDate.
Los métodos diagnósticos invasivos incluyen: test de ureasa, estudio histológico, cultivo y reacción en cadena de la polimerasa (PCR). Los métodos diagnósticos no invasivos son: test de aliento, test de antígeno en heces, test serológicos y reacción en cadena de la polimerasa (PCR) (Tabla 1).
Tabla 1
Situaciones en las que está indicado realizar test no invasivos e invasivos análogos.
Medicación que debería ser suspendida antes de realizar el test diagnóstico
Hay medicación que puede reducir la carga bacteriana de H. pylori en la mucosa gástrica y, por tanto, se recomienda su suspensión antes de realizar los test diagnósticos invasivos y no invasivos para el diagnóstico de infección activa por H. pylori. De lo contrario, esto se traduciría en una disminución de su sensibilidad en el diagnóstico de la infección. Este es el caso de los inhibidores de la bomba de protones (IBP), los cuales, deberían ser suspendidos dos semanas antes de realizar el test diagnóstico. También para los antibióticos y fármacos que contengan bismuto se recomienda evitarlos en las cuatro semanas previas a la realización del test diagnóstico.
Cuando las pruebas diagnósticas se realizan para comprobar la erradicación de la infección por H. pylori, estas deben realizarse una vez transcurridas al menos cuatro semanas desde la finalización del tratamiento erradicador.
Test diagnósticos no invasivos
El test del aliento con Urea (UBT) y la determinación de antígeno en heces nos permiten determinar presencia de infección activa mientras que el test serológico, cuando es positivo, no puede diferenciar entre infección activa o pasada.
Test del aliento con Urea marcada con Carbono 13 o 14
Se basa en la capacidad de la ureasa del H. pylori para hidrolizar una solución de urea marcada con un isótopo de carbono (13C o 14C). Si la bacteria está presente, la actividad ureasa desdobla el enlace Carbono-urea, dando lugar a la producción de amonio y CO2, este último pasa a sangre y de aquí es eliminado por el pulmón incrementando así la proporción del isótopo de Carbono en el aire espirado.
Se prefiere el isótopo de carbono 13C porque no es radiactivo. El isótopo de carbono 14C, aunque es más barato, es radiactivo, pero la radiación que emite es baja y comparable a la exposición diaria a radiación a la que se puede someter una persona en su vida diaria. Otro inconveniente es que el resultado de la prueba con carbono 14C espirado debe ser medido en un laboratorio de medicina nuclear mientras que el 13C espirado es medido mediante un espectrómetro de masas en la propia consulta de digestivo. Así, habitualmente se prefiere el isótopo 13C porque es estable, no radiactivo y puede usarse tantas veces como se necesite, también en embarazadas y niños. El test del aliento con 13C es sencillo de realizar con una duración de unos 30-40 minutos, es seguro, preciso, ampliamente disponible, coste-efectivo y presenta una elevada sensibilidad (S) 88-95% y especificidad (E) 95-100%.
Se aconseja aplicar el protocolo europeo para su realización, consistente en administrar ácido cítrico previo a la solución con urea marcada, para disminuir riesgo de falsos positivos (FP) y falsos negativos (FN), pues retrasa el vaciamiento gástrico y optimiza absorción de urea. En este protocolo además se toman 2 muestras de aliento, una basal y otra a los 30 minutos[1].
Los resultados falsos positivos son poco frecuentes con este test, siendo la principal limitación de este test su baja sensibilidad en presencia de sangrado gastrointestinal activo[2] y en pacientes que toman o han tomado recientemente IBP, antibióticos o bismuto. En estos casos un resultado negativo puede deberse a un falso negativo.
Los fármacos antagonistas de receptores H2 tienen un mínimo efecto en la sensibilidad[3] y los antiácidos sin bismuto probablemente no afectan a resultado del test[4].
Test de Antígeno en heces
Es un test muy usado en la práctica clínica diaria al igual que el test del aliento. Es seguro, preciso y coste-efectivo. Usa una técnica de ELISA para detectar antígeno (Ag) de H. pylori en heces usando anticuerpos (Ac) anti-H. pylori poli o monoclonales. Actualmente se usa la técnica de ELISA con Ac monoclonales, porque tiene mayor sensibilidad (94%) y especificidad (97%), siendo comparable a test de aliento con Urea[5]. La técnica de ELISA con Ac policlonales está en desuso por su baja sensibilidad.
Es el test más coste-efectivo en áreas con una prevalencia de H. pylori >30%[6].
Detecta infección activa, lo que permite el diagnóstico inicial de la infección y también confirmar la erradicación[7]. En presencia de sangrado gastrointestinal activo su especificidad puede disminuir, pero su sensibilidad no se ve afectada[8]. El uso de inhibidores de la bomba de protones, antibióticos y bismuto puede afectar al resultado del test, por lo que deben ser suspendidos antes de realizar el test.
Test Serológicos
Utilizan una técnica ELISA para detectar anticuerpos IgG frente a H. pylori en una muestra de suero. Su composición puede variar entre regiones geográficas según la composición antigénica de la cepa circulante, por lo que requiere validación local para su uso, esto hace que sea poco útil en la práctica clínica diaria. En general, no se recomiendan para diagnosticar infección ni para comprobar erradicación, puesto que los anticuerpos persisten largo tiempo después de la infección, incluso habiendo comprobado la erradicación. Por tanto, no permiten distinguir entre infección por H. pylori aguda y pasada, lo que es especialmente relevante en pacientes sometidos a tratamiento erradicador. La prevalencia de la infección afecta a la precisión diagnóstica del test, así en poblaciones de baja prevalencia (<20%) su valor predictivo positivo (VPP) disminuye, por lo que un resultado positivo será probablemente un falso positivo, por tanto, será necesario confirmar el resultado con un segundo test (test del aliento o test de antígeno en heces) antes de iniciar el tratamiento erradicador. Sin embargo, su valor predictivo negativo (VPN) aumenta (>90%), por lo que un resultado negativo permite descartar infección con seguridad, siendo de utilidad como test de screening para excluir infección[9].
Los test serológicos pueden ser útiles para diagnosticar la infección, en ausencia de tratamiento erradicador previo, en las siguientes situaciones:
+ En procesos que reducen marcadamente la densidad de infección por H. pylori (atrofia o metaplasia intestinal extensas, linfoma MALT, carcinoma gástrico, sangrado gastrointestinal agudo). No obstante, es improtante subrayar que, para comprobar la erradicación de la infección en situaciones de riesgo como la úlcera péptica complicada con hemorragia digestiva, debe emplearse un test con elevada sensibilidad y especificidad.
+ Si no se pueden suspender los inhibidores de la bomba de protones previo a realizar el test diagnóstico o el paciente ha tomado de forma reciente antibióticos[3].
+ En enfermedad ulcerosa péptica, dada su alta probabilidad pre-test de presentar infección[10].
Los test serológicos rápidos podrían facilitar la estrategia "test-and-treat" pero actualmente no disponen de adecuada sensibilidad y especificidad para poder emplearlos en la práctica habitual.
Los test serológicos que detectan específicamente los anticuerpos CagA, que permanecen positivos durante mucho tiempo, podría permitir detectar infección por H. pylori en pacientes con cáncer gástrico cuando otros test son negativos. La evidencia actual apoya a los test serológicos con pepsinógeno I y II como los test no invasivos más útiles para conocer el estado de la mucosa gástrica (no atrofia vs atrofia). En la Conferencia de Consenso Global de Kyoto, los expertos coincidieron en afirmar que los test serológicos con pepsinógeno I y II y anticuerpos anti-H. pylori, son útiles para identificar pacientes con riesgo aumentado de presentar cáncer gástrico[11].
Test diagnósticos invasivos
Test de ureasa
Es el método diagnóstico de primera elección cuando hay indicación de endoscopia y no requiere biopsias para estudio histológico[3].
Pone en contacto una biopsia de mucosa gástrica con un medio que contiene urea y un indicador de pH. Si hay ureasa, el pH se alcaliniza y se produce un cambio de color, indicando un resultado positivo.
Se aconseja tomar 1 biopsia de cuerpo y otra de antro[3]. Es un método sencillo, barato, rápido y presentan una elevada sensibilidad (90%) y especificidad (95%). Hay varios tipos de test comercializados que se diferencian en el medio usado, los reactantes y el tiempo en obtener el resultado (1 a 24 horas), sin que se modifiquen sensibilidad ni especificidad.
Los falsos positivos son poco frecuentes y generalmente se deben a la presencia en mucosa gástrica de bacterias productoras de ureasa. Los falsos negativos son más frecuentes y pueden ocurrir en determinadas circunstancias como presencia de sangrado gastrointestinal agudo, toma reciente de IBP, antibióticos, bismuto o por presencia de extensa atrofia/ metaplasia intestinal. En estos casos, un resultado negativo no excluye infección.
Obteniendo biopsias de antro y fundus se podría aumentar la sensibilidad y también si tomamos mayor número de biopsias (pasando de 1 a 4)[12].
El principal interés del test radica en obtener un resultado rápido que permita prescribir tratamiento erradicador de forma inmediata.
El Consenso Maastrich V de 2017 no recomienda el test de ureasa para comprobar erradicación, con un Grado de recomendación: B y Nivel de evidencia 2b, puesto que su sensibilidad disminuye al disminuir la densidad de infección por H. pylori[3].
Histología
Detecta la presencia de H. pylori o alteraciones histológicas asociadas a la infección que suponen signos indirectos de infección en caso de no poder detectar el germen. Además, permite estudiar lesiones gástricas como la gastritis, atrofia gástrica, metaplasia intestinal y neoplasias.
Presenta una elevada sensibilidad (95%) y especificidad (98%). Algunos autores lo consideran el "gold estándar" para detección de infección por H. pylori. Hay factores pueden que pueden afectar al diagnóstico, como el número y localización de biopsias, el método de tinción utilizado y la experiencia del patólogo. La sensibilidad puede disminuir en presencia de sangrado gastrointestinal agudo, gastritis atrófica y tratamiento con inhibidores de la bomba de protones puesto que en estos casos se produce una migración proximal de H. pylori del antro al cuerpo gástrico[13]. Por ello, se recomienda tomar biopsias de antro y cuerpo, especialmente si sospechamos gastritis atrófica multifocal y/ó metaplasia intestinal. La AGA 2017 recomienda, en sospecha de atrofia gástrica el Sistema Sydney para la toma de biopsias en el que se toman un mínimo de 5 biopsias en las siguientes localizaciones: 2 en antro gástrico de las cuales una se toma en curvatura mayor y otra en curvatura menor gástrica, otra biopsia en incisura angularis y 2 biopsias en cuerpo gástrico, una de ellas en curvatura menor y otra hacia la mitad de curvatura mayor[10].
La tinción usada habitualmente es la hematoxilina-eosina pero se pueden usar tinciones más especializadas para mejorar la precisión diagnóstica en determinadas circunstancias, así la tinción con Giemsa se recomienda ante la sospecha gastritis crónica y la tinción con inmunohistoquímica se aconseja sólo cuando con las tinciones histoquímicas no se detecta la presencia de H. pylori y se sospecha que pueda estar motivado por una disminución de la carga de H. pylori como es el caso de la gastritis crónica (activa o inactiva), gastritis atrófica (extensa metaplasia intestinal), en biopsias de seguimiento después de tratamiento erradicador y si el paciente ha tomado recientemente antibióticos, sobre todo si existe alta probabilidad pretest de infección.
Cultivo y estudio de susceptibilidad antimicrobiana
Las muestras para cultivo se obtienen mediante biopsia, muestra de jugo gástrico o mediante entero-test (los dos últimos con menor sensibilidad).
El cultivo nos permite identificar la presencia de H. pylori, pero su principal utilidad es determinar su sensibilidad a los diferentes antibióticos, principalmente metronidazol, claritromicina, levofloxacino, rifampicina y ocasionalmente amoxicilina y tetraciclina, mediante la realización de un antibiograma.
Presenta una especificidad del 100% y una sensibilidad inferior al test de ureasa y la histología, puesto que el H. pylori es una bacteria difícil de cultivar[14].
La presencia de sangrado gastrointestinal activo puede disminuir su sensibilidad.
La precisión diagnóstica de esta técnica depende de la calidad de la muestra, la experiencia del microbiólogo y el tipo de medio de transporte empleado[15].
En la práctica, se usa para realizar un estudio de resistencias a antibióticos en aquellos pacientes en los que han fallado varios intentos de tratamiento erradicador.
El Consenso de Maastrich V recomienda que, después del primer intento de tratamiento erradicador fallido, si el paciente requiere endoscopia, se tomen muestras para cultivo y estudio de susceptibilidad antimicrobiana para realizar un tratamiento antibiótico dirigido antes de dar una segunda línea de tratamiento, pues la probabilidad de tener un microorganismo resistente a claritromicina es elevada (60-70%). El estudio de susceptibilidad antimicrobiana debe considerarse sobre todo si se va a administrar un tratamiento que incluya levofloxacino porque en algunas regiones existe una alta tasa de resistencias a fluoroquinolonas lo que puede llevar consigo un fracaso del tratamiento erradicador. Por el contrario, si se decide usar una cuádruple terapia con bismuto, no se recomienda realizar un estudio de susceptibilidad antimicrobiana porque el riesgo de resistencia a tetraciclinas es muy bajo y la resistencia a metronidazol no tiene impacto.
REACCIÓN EN CADENA DE LA POLIMERASA (PCR): TEST INVASIVO Y NO INVASIVO
Permite detectar DNA bacteriano cuando existe baja carga de H. pylori además identifica mutaciones específicas asociadas con resistencia a antibióticos[16].
Puede realizarse de forma invasiva mediante toma de biopsia gástrica y no invasiva utilizando muestras de saliva, heces,… y no requiere un transporte especializado.
El principal inconveniente de este test es la posibilidad de falsos positivos por presencia de material genético residual de H. pylori tras realizar tratamiento erradicador o por la presencia de otra flora bacteriana productora de ureasa[17]. Además el coste de este método diagnóstico es elevado y no tiene una amplia disponibilidad, por lo que es un método poco empleado en la actualidad.
Manejo de los test diagnósticos no invasivos en el diagnóstico de la infección por Helicobacter pylori
El test del aliento con Urea marcada (UBT) es el método de elección para el diagnóstico de la infección por H. pylori, es el test mejor estudiado y más recomendado en la estrategia "test and treat".
La determinación de Ag de H. pylori en heces con la técnica de ELISA monoclonal es una alternativa al test del aliento en el diagnóstico de la infección por H. pylori debido a su elevada sensibilidad y especificidad[1],[3].
Los test serológicos en general no se recomiendan en el diagnóstico de la infección, aunque podrían usarse sólo tras validación local. Pueden ser útiles para el diagnóstico de la infección en situaciones que reducen marcadamente la densidad de infección por H. pylori y en pacientes que no pueden suspender el tratamiento con inhibidores de la bomba de protones o que han recibido recientemente antibióticos, siempre en ausencia de tratamiento erradicador previo. También son útiles para excluir infección por H. pylori en poblaciones con baja prevalencia.
En resumen, en aquellos pacientes que no requieren una endoscopia digestiva alta para el diagnóstico o vigilancia de alguna lesión gástrica, se puede realizar un test del aliento (UB-test) o un test de antígeno de H. pylori para diagnosticar la infección. Si el resultado es positivo, confirmaría la infección permitiendo iniciar un tratamiento erradicador. Sin embargo, un resultado negativo sólo descartaría la infección si el paciente no ha tomado previamente inhibidores de la bomba de protones, antibióticos o fármacos que contengan bismuto. En caso contrario, habría que suspender el tratamiento con inhibidores de la bomba de protones durante dos semanas o suspender antibioterapia/bismuto durante 4 semanas y volver a repetir el test del aliento con Urea marcada o el test de Ag de H. pylori en heces, en cuyo caso, si obtenemos un resultado negativo, podríamos descartar la infección (Figura 2).
Manejo de los test diagnósticos invasivos en el diagnóstico de la infección por Helicobacter pylori
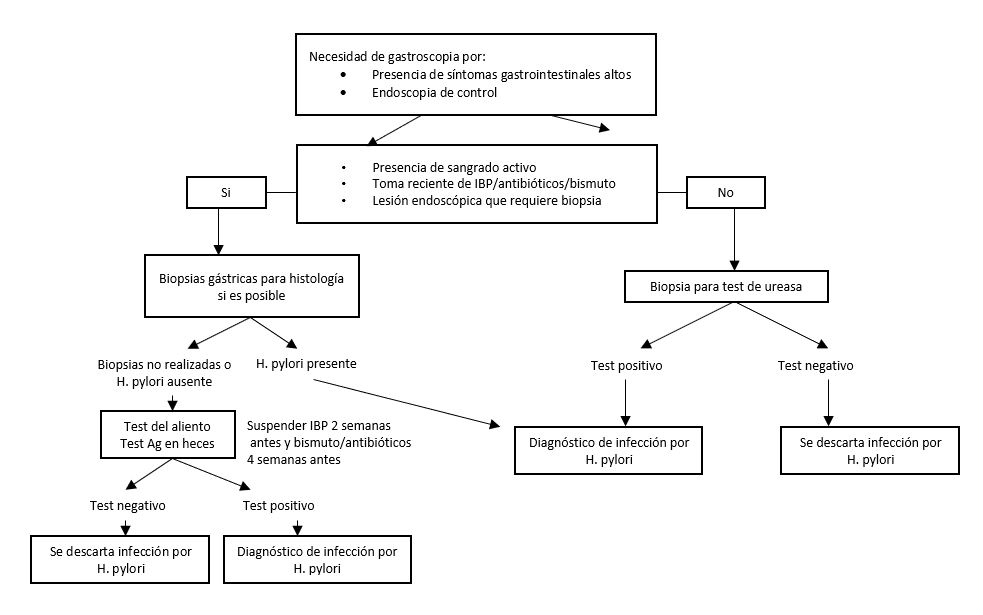
En un paciente que requiere realización de gastroscopia por presentar síntomas que así lo indiquen o por tener patología que requiere seguimiento, la elección del test diagnóstico dependerá de la presentación clínica y los hallazgos endoscópicos:
Ausencia de sangrado agudo en la endoscopia:
Si se requiere realizar estudio histológico de alguna lesión (por ejemplo gastropatía, úlcera gástrica,…) o el paciente ha tomado recientemente IBP, antibióticos o bismuto, se deben tomar biopsias gástricas para realizar un diagnóstico histológico que nos permita detectar presencia de infección por H. pylori, para lo que se recomienda seguir el sistema Sydney para la toma de biopsias. En caso contrario, está indicado realizar test de ureasa para el diagnóstico de la infección.
Si el resultado es negativo para infección por H. pylori en el estudio histológico y el paciente ha tomado previamente inhibidores de la bomba de protones, antibióticos o bismuto, se aconseja realizar un test del aliento o test de Antígeno en heces tras suspender estos fármacos el tiempo correspondiente para descartar que el resultado negativo sea un falso negativo.
Si el paciente presenta antecedente de tratamientos erradicadores de infección por H. pylori previos fallidos, se aconseja toma de biopsias gástricas para realizar cultivo y estudio de susceptibilidad antimicrobiana.
Presencia de sangrado agudo:
Se recomienda tomar biopsias gástricas en la endoscopia inicial sólo si es posible.
+ Si el resultado es negativo, este puede ser un falso negativo, por lo es necesario realizar otro test para confirmar este diagnóstico, siendo preferible el test aliento.
+ Si el resultado es positivo, esto confirmaría infección por H. pylori, por lo que habría que iniciar tratamiento erradicador.
Si no ha sido posible tomar biopsias durante endoscopia, se recomienda realizar un test del aliento (UBT) o un test de antígeno de H. pylori en heces una vez que el sangrado cese y se pueda suspender con seguridad el tratamiento con inhibidores de la bomba de protones durante 2 semanas (Figura 3).
Manejo de los test diagnósticos para comprobar curación de la infección tras tratamiento erradicador.
Se recomienda comprobar la erradicación de la infección en todos los casos, debido a la creciente resistencia del H. pylori a los antibióticos, que puede dar lugar a persistencia de la infección y por tanto, que los pacientes continúen en riesgo de presentar complicaciones asociadas a H. pylori tales como sangrado de úlcera péptica, desarrollo de cáncer gástrico,…Además, la disponibilidad de test no invasivos relativamente baratos y fáciles de realizar, con elevada sensibilidad y especificidad como son el test del aliento y la determinación de antígeno de H. pylori en heces, facilita la comprobación de la curación de la infección.
Hay patologías en las que la indicación de tratamiento de la infección por H. pylori es clara, como puede ser la úlcera péptica complicada con sangrado. Pero hay otras patologías en las que comprobar la erradicación de la infección puede ser controvertido desde un punto de vista coste-efectivo. Este es el caso de la dispepsia funcional en la que los síntomas habitualmente persisten incluso tras erradicar la infección por H. pylori. En estos pacientes, comprobar el éxito del tratamiento erradicador puede ser de utilidad para decidir si continuar el estudio para descartar otras patologías como causa de los síntomas o bien iniciar otros tratamientos enfocados a otras posibles etiologías de los síntomas. Por último, comprobar la erradicación de la infección es útil para conocer la tasa de éxito del tratamiento erradicador en una comunidad, lo que puede derivar incluso en la necesidad de modificar el tratamiento antibiótico para aumentar la tasa de éxito del tratamiento.
El test para confirmar erradicación debe realizarse al menos 4 semanas después de finalizar el tratamiento erradicador y los inhibidores de la bomba de protones deben suspenderse 2 semanas antes de realizar el test.
Como prueba no invasiva, se considera de elección el test del aliento con urea marcada con 13C (UBT) debido a que es una técnica fácil de realizar y a su elevada sensibilidad y especificidad en esta situación.
La determinación de antígeno en heces mediante la técnica de ELISA monoclonal es una alternativa válida al test del aliento para comprobar erradicación de la infección[1],[3],[10].
No se recomienda el uso de los test serológicos para comprobar la erradicación, debido a la persistencia de los anticuerpos frente a H. pylori en sangre durante largo tiempo, incluso si la infección se ha curado.
Cuando sea necesaria la realización de gastroscopia de control, como puede ocurrir en el caso de la úlcera gástrica para descartar malignidad o el linfoma MALT para evaluar su regresión, la erradicación puede comprobarse mediante métodos basados en la biopsia gástrica[1],[10], si bien, el test de ureasa no se recomienda para comprobar erradicación porque al disminuir la población de H. pylori en mucosa gástrica puede dar lugar a un falso negativo en el caso de un resultado negativo con este test[3].

 Descargar número completo
Descargar número completo Download full issue
Download full issue