CITA ESTE TRABAJO
Grilo Bensusan I, Torres Gómez J. Colitis microscópica. RAPD 2025;48(1):54-62. DOI: 10.37352/2025482.1
Introducción
La colitis microscópica (CM) es una enfermedad inflamatoria que afecta al intestino grueso y que incluye la colitis colágena (CC), la colitis linfocítica (CL) y recientemente a las formas incompletas de la misma: CM incompleta[1]. Su diagnóstico se basa fundamentalmente en los hallazgos histológicos obtenidos mediante el estudio de biopsias colónicas en pacientes con una diarrea acuosa persistente. Se trata de una patología cuya incidencia ha aumentado en los últimos años, equiparándose en algunas regiones a la enfermedad inflamatoria intestinal. La implicación y la colaboración del gastroenterólogo y del patólogo son importantes para un adecuado diagnóstico del paciente.
Definición
La CM, según las recomendaciones del grupo español de CM, es un término genérico que incluye a la CL y a la CC. Se refiere a una enfermedad inflamatoria del intestino que se caracteriza por la existencia de una diarrea crónica o intermitente, sin sangre en las heces, con hallazgos macroscópicos en la colonoscopia que son normales o casi normales y que presenta unas características histológicas definidas[2]. Cuando estas características histológicas no se cumplen de manera completa, en pacientes con síntomas compatibles, se ha acuñado el término de CM incompleta[3].
Epidemiología
La CC fue descrita, por primera vez, hace más de cuatro décadas, en el año 1976 por Lindstrom. El término CM se introdujo por Read et al en el año 1980 y finalmente Lanzeby introduce el término de CL[4]. Hoy en día, el término CM incluye a la CC, la CL y a la CM incompleta[1].
La incidencia de la CM de manera global se estima en 11.4 casos por cada 100.000 hab/año[3]. Existen diferencias entre países desde los 6,8 a los 24,7 cada 100.000 habitantes /año[1]. Con respecto a la CC, en el Norte de Europa y en Norte América varía entre los 5,2 y 10,8 casos por cada 100.000 habitantes/año, siendo inferior en España situándose en menos de 2,9 casos por cada 100.000 habitantes/año. La CL es más frecuente, con una incidencia en el Norte de Europa y Norte América de 4 a 19 casos por cada 100.000 hab/año y en España de 2,3 a 16 casos por 100000 hab/año[2]. Su incidencia ha ido aumentando en las últimas décadas, aunque parece haber alcanzado unos niveles estables a partir de la década del 2010[1]. Este aumento ha provocado que su incidencia se equipare a la de la enfermedad inflamatoria intestinal y en algunos países supere la incidencia de la enfermedad de Crohn[5],[6]. El aumento de la incidencia se atribuye a un mayor acceso a la realización de una colonoscopia, a una mayor sospecha y concienciación por parte de los gastroenterólogos y patólogos, y por una mayor exposición a factores de riesgo, pero ninguno de estos aspectos ha sido confirmado mediante estudios diseñados con dicho objetivo[1],[6].
La incidencia es de 2 a 8 veces superior en mujeres que en hombres. Esta diferencia es mayor cuanto mayor es la edad del diagnóstico y mayor en la CC frente a la linfocítica[1]-[3].
El riesgo de padecer una CM aumenta con la edad, con un pico de incidencia que se produce en la séptima década de la vida con una edad media para el diagnóstico de la CC de 64,9 años y de 62,2 años en la CL, entre 61.1 +/- 6,5 años en la CM globalmente[2],[7]. Sin embargo, hasta un 25 % de los casos se producen en menores de 45 años y también se han descritos casos en niños[2].
La prevalencia estimada de la CM es de 119 casos/100000 hab, siendo para la CC de 50,1 por cada 100.000 hab y para la CL de 61,7 por cada 100.000 habitantes[3].
Patogenia
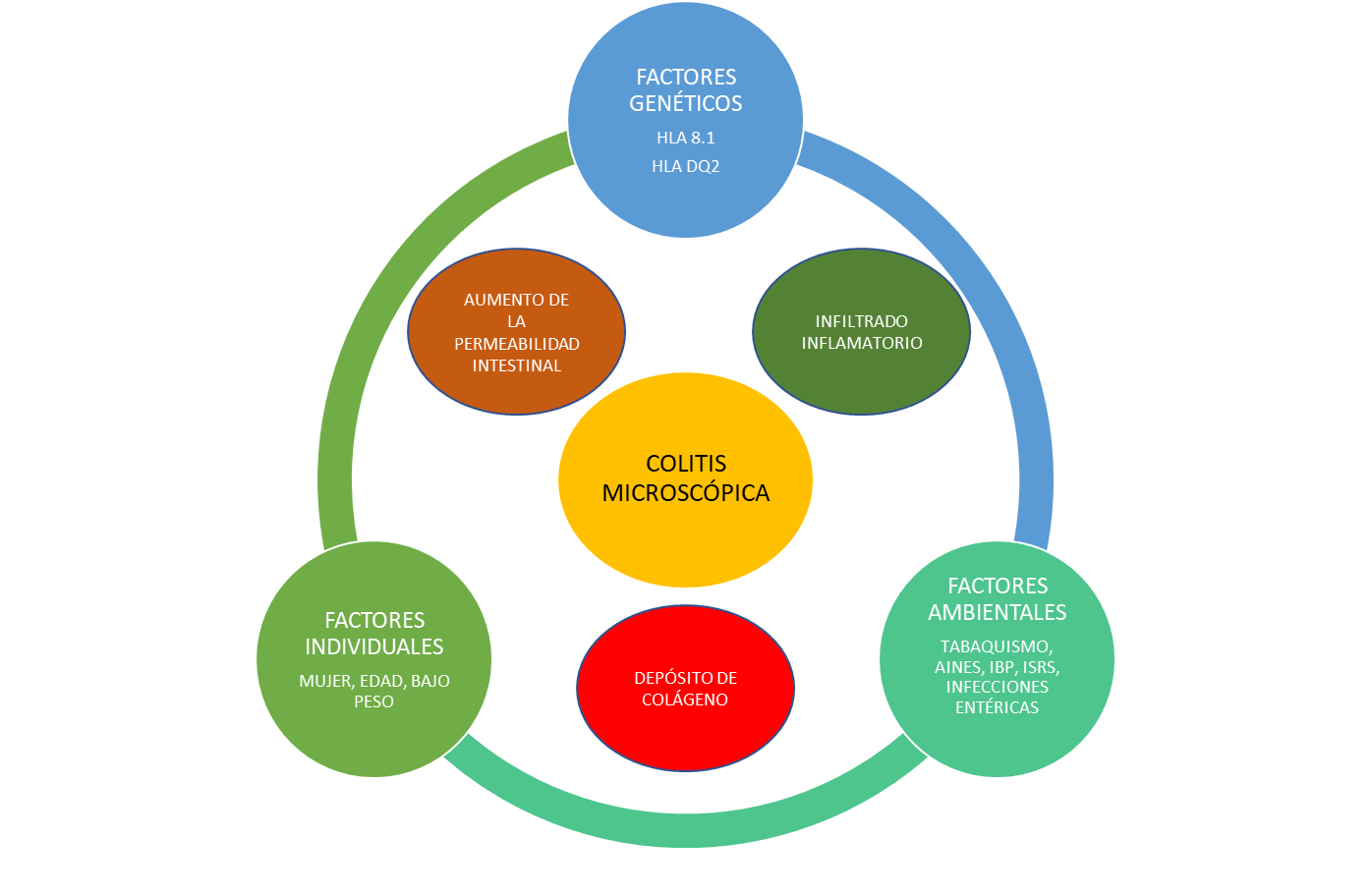
La patogenia de la CM es desconocida. La hipótesis más aceptada es la existencia de una respuesta inmunológica inadecuada, como respuesta a estímulos de la mucosa colónica, en personas genéticamente susceptibles. Esta respuesta provoca una inflamación de la mucosa que da lugar al síntoma fundamental de la enfermedad que es la diarrea[1],[6]. (Figura 1)
Con respecto a la respuesta inmune, el infiltrado que se observa en la lámina propia en la CM está formado por linfocitos CD8 citotóxicos y linfocitos CD4 helpers. Su presencia provoca un aumento de citoquinas, interleucinas, factor de necrosis tumoral e interferón gamma que actúan como factores proinflamatorios. La formación del colágeno se asocia a un desequilibrio en su proceso de producción y destrucción, asociados al aumento de expresión del factor de crecimiento tumoral beta (TGF-β)[1],[6]. Esta respuesta inflamatoria provoca un aumento de la permeabilidad intestinal, mediada por el IFN-gamma y por el TGF-β y que se asocia a una disminución de las claudinas unas proteínas responsables de las uniones intercelulares del epitelio colónico[1].
Los desencadenantes de esta respuesta inmune inadecuada son desconocidos. Se implican fundamentalmente a la exposición a productos bacterianos, a fármacos o a otros productos químicos. En relación con las bacterias, un reciente estudio danés asocia la incidencia de CM a infecciones entéricas por Campylobacter jejuni y Campylobacter concisus, sin asociarse con la infección por Salmonella spp. También se implica a la microbiota en la patogénesis de la enfermedad en base a su mejoría cuando se deriva el flujo fecal mediante una ileostomía, o la aparición o mejoría del cuadro cuando se realiza un trasplante fecal. Algunos hallazgos reseñables en la microbiota de los pacientes con CM son la existencia de una disbiosis con una reducción de la diversidad de las especies. Entre ellas se observa una reducción en la familia Ruminococcaceae, Collinsela, Coriobacteriaceae, Clostridiales, Akkermansia y Alistipes. No obstante, son necesarios más estudios para corroborar estos hallazgos[1]. Los fármacos que se asocian a un mayor riesgo de CM son los inhibidores de la bomba de protones (IBPs), los antiinflamatorios no esteroideos (AINEs) y los inhibidores selectivos de la recaptación de la serotonina (ISRS) (Tabla 1). Sin embargo, esta asociación no implica su relación causal. El uso crónico de IBPs aumenta el riesgo significativamente de CM con una OR de 2,95 (IC 95%: 1,82-4,8). Este riesgo es mayor para la CC. El mecanismo propuesto para este aumento de riesgo parece estar relacionado con la modificación de la permeabilidad intestinal y de la microbiota intestinal. Los AINES también aumentan el riesgo de CM con una OR de 2,4 (IC 95%: 1,99-2,89). El uso concomitante de IBP y AINES podría incrementar aún más el riesgo. Finalmente, los ISRS también aumentan el riesgo con una OR de 2,98 (IC 95%, 2,35-3,78). No se conocen los mecanismos por los que los AINES y los ISRS favorecen el desarrollo de la CM. Otros fármacos que pueden aumentar el riesgo son la terapia hormonal sustitutiva en mujeres, asociándose un mayor riesgo a un mayor tiempo de tratamiento. También la inmunoterapia oncológica produce enterocolitis que en algunos casos cumple los criterios histológicos de CM. En estos casos existe respuesta a budesónida y tienen mejor pronóstico que otras formas de enterocolitis provocadas por estos fármacos. Una menor evidencia de su implicación en el desarrollo de CM tiene la ticlopidina, los betabloqueantes, los inhibidores de enzima convertidora de angiotensina (IECAs), y los antagonistas del receptor de angiotensina 2 (ARA-2), antidiabéticos orales y estatinas[1],[3].
Tabla 1
Fármacos asociados a un mayor riesgo de CM. IBP: Inhibidores de la bomba de protones. AINEs: Antinflamatorios no esteroideos. ISRS: inhibidores selectivos de la recaptación de serotonina. ARA-2: Antagonistas de los receptores de la angiotensina II.
El tabaquismo es otro factor que aumenta el riesgo para padecer una CM. El antecedente de consumo supone un aumento de riesgo con una OR de 1,6 (IC 95%, 1,4-1,9), mientras que el consumo activo aumenta el riesgo con una OR de 2,99 (IC 95 %, 2,15-4,15), siendo mayor para la CC (OR: 5,5, IC 95 %: 3,4-8,9). El mecanismo implicado es la alteración de la barrera intestinal, la alteración de la inmunidad humoral y celular, la alteración de la microbiota intestinal y la estimulación de la fibrogénesis por estimulación del TGF-β[1],[3]. Un menor índice de masa corporal podría aumentar el riesgo de CM. No existen datos concluyentes con respecto al consumo de bebidas alcohólicas[1].
Finalmente, desde el punto de vista genético se han detectado haplotipos del complejo HLA que aumentan el riesgo para padecer una CM. Concretamente el haplotipo ancestral HLA 8.1 se asocia a la CC, aunque no a la CL. La CC también se ha asociado a alelos más frecuentes en la enfermedad de Crohn y en la colitis ulcerosa. También se ha asociado con alteraciones en el cromosoma 6 (HLA DQ2) asociado a enfermedad celíaca[1],[6].
Clínica
El síntoma fundamental de la CM es la diarrea de tipo acuoso, crónica o intermitente, y sin sangre. La intensidad de la diarrea puede ser variable, aunque la media suele ser de 6-7 dep/día. El comienzo de la diarrea puede ser agudo en un tercio de los casos, pero suele ser insidiosa y antes del diagnóstico puede persistir durante unos 6 meses. Puede existir diarrea nocturna en un 25-50 % de los casos[2],[3].
Para determinar la gravedad de la diarrea se recomienda usar los criterios de Hjortswang que establecen que existe una remisión clínica de la colitis cuando existe una media durante una semana de menos de 3 deposiciones al día y menos de 1 deposición acuosa al día. Existe también un índice de actividad de la CM (MCDAI) que incluye como criterios de gravedad el número de deposiciones sin forma al día, los episodios nocturnos, el dolor abdominal, la pérdida de peso, la urgencia defecatoria y la incontinencia fecal. Los criterios de Hjortswang han sido usados en más estudios incluyendo ensayos clínicos, probando su utilidad en la vida real, por lo que son los recomendados por la guía europea[3].
El mecanismo por el cual se produce la diarrea en la CM no es del todo conocido, pero parece ser de origen multifactorial. En primer lugar, existe un componente osmótico puesto que el ayuno mejora los síntomas. También existe un mecanismo inflamatorio y secretor asociado. El papel de la malabsorción de ácidos biliares en la clínica de la diarrea y la patogénesis de la CM no está claramente establecido. Hasta en un 44 % de pacientes con CM tienen asociada una malabsorción de ácidos biliares demostrada mediante la técnica SeHCAT. Además, en pacientes con CM se observa una disminución del receptor X farnesoide a nivel colónico y en estudios en animales, el uso de agonistas de dicho receptor reduce el grado de inflamación colónica. Sin embargo, son estudios con muestras limitadas[1],[2].
Además de la diarrea, otros síntomas frecuentes son el dolor abdominal (50-70 %), distensión abdominal, urgencia defecatoria (70%) solapándose los síntomas por tanto con una diarrea funcional o síndrome de intestino irritable con predominio de diarrea. También puede presentar incontinencia fecal (40 %) y discreta pérdida de peso en hasta el 50 % de los casos[2].
En los pacientes con CM es más frecuente la presencia de enfermedades autoinmunes, estando presente entre el 30-50 % de los casos. La más frecuente de todas es la enfermedad celíaca, estando presente entre el 2-20 % de los pacientes con CM, recomendándose su cribado serológico en los pacientes con CM y especialmente si no hay respuesta al tratamiento[2],. Otras enfermedades autoinmunes asociadas son la diabetes tipo 1, la tiroiditis autoinmune, la artritis reumatoide, el síndrome de Sjögren y la psoriasis[2].
Historia natural
La CM puede presentarse como un solo episodio de diarrea de unos meses de duración, como una diarrea crónica persistente o con episodios intermitentes de diarrea. No se conocen las tasas de remisión espontánea, aunque se sitúan en torno al 51 %. En el resto se observa una dependencia a corticoides en el 22 % de los casos y una recidiva tras un primer episodio en el 28 % de los casos[2],[3].
Sigue sin aclararse si la CC y la CL son dos subtipos histológicos de la misma enfermedad o son enfermedades diferentes[2]. Tampoco se conoce la evolución natural de la CM incompleta, aunque los datos sugieren que tiene una mayor tendencia a la remisión espontánea[3].
La CM no se asocia a un aumento de la mortalidad, ni a un mayor riesgo de enfermedad inflamatoria intestinal, ni a un aumento del riesgo de cáncer colorrectal, por lo que no se recomiendan estrategias específicas de cribado de dicho tumor[1],[3]. Entre las complicaciones poco frecuentes se encuentra la perforación colónica espontánea o tras una colonoscopia[2].
Aunque no se observe un aumento de la mortalidad, la CM sí se asocia a una menor calidad de vida que se correlaciona con una mayor actividad y gravedad de la enfermedad y sus comorbilidades. La calidad de vida mejora con el tratamiento con budesónida. No obstante, incluso en ausencia de actividad, los cuestionarios de calidad de vida ofrecen puntuaciones inferiores que la población sana, con mayor prevalencia de ansiedad, depresión y somatización[1].
Diagnóstico
El diagnóstico de la CM, tal y como se mencionó al principio, se basa en el hallazgo de unas características histológicas definidas en las biopsias colónicas obtenidas mediante una colonoscopia. Por lo tanto, la realización de la colonoscopia, la toma de biopsias y su posterior análisis anatomopatológico son cruciales para el diagnóstico. Ello es debido a que ni desde el punto de vista clínico, ni analítico, ni de los hallazgos macroscópicos de la colonoscopia existen criterios para establecer un diagnóstico.
En el diagnóstico diferencial de la diarrea crónica acuosa se incluyen procesos orgánicos como infecciones, la enfermedad celíaca, la enfermedad inflamatoria intestinal, el sobrecrecimiento bacteriano y el cáncer de colon. Pero también, se incluye la patología funcional como el síndrome de intestino irritable con predominio de diarrea y la diarrea crónica funcional[8]. En un metaanálisis se observó que en un 33,4 % de los casos con CM cumplirían los criterios diagnósticos de SII-D. En otro estudio, entre un 6-9 % de los pacientes con SII-D y con diarrea crónica funcional tenían realmente una CM, cuando se les realizaba una colonoscopia con biopsias[1],[3]. En un intento para reducir el número de colonoscopias y biopsias y aumentar el diagnóstico de la CM, se estableció un sistema de puntuación. En este sistema se puntúa la edad mayor o igual a 55 años, la evolución de la diarrea de menos o igual a 6 meses, la existencia de 5 o más deposiciones al día, un índice de masa corporal menor a 30 kg/m2, el tabaquismo activo y el tratamiento con AINEs o ISRS. Una puntuación mayor o igual a 10, tenía una sensibilidad de un 91-93 % con una especificidad del 49 % para el diagnóstico de CM. (Tabla 2)[9] No obstante, las recomendaciones de la guía europea y española de CM establecen que se debe realizar una colonoscopia con biopsias en pacientes con diagnóstico clínico de SII-D o diarrea funcional, cuando no haya respuesta al tratamiento o cuando existan factores de riesgo para la CM. Las recomendaciones de la AGA con respecto a la realización de una colonoscopia con toma de biopsias en el contexto del SII-D y la diarrea funcional son más ambiguas, considerándolas como no necesarias en ausencia de síntomas de alarma o en menores de 50 años en los casos de SII-D, aunque refiere que es el único método para descartarla en los casos de DF[8].
Tabla 2
Factores predictores de CM en la diarrea crónica. IMC: Índice de masa corporal. ISRS: Inhibidores selectivos de la recaptación de serotonina. IRSN: Inhibidores de la recaptación de serotonina-noradrenalina. AINEs: Antiinflamatorios no esteroideos.
| Factores predictores de CM en la diarrea crónica[9]. | |
| Factor | Puntos asignados |
| Edad ≥ 55 años | 6 |
| Duración de la diarrea ≤ 6 meses. | 5 |
| IMC menor a 30 kg/m2 | 3 |
| Número de deposiciones ≥ 5 /d (media desde el comienzo de los síntomas) | 3 |
| Tabaquismo activo | 3 |
| Tratamiento actual con ISRS o IRSN | 2 |
| Tratamiento actual con AINEs | 2 |
| Puntuación ≥ 10 puntos: sensibilidad 91-93 %, especificidad 49 % para el diagnóstico de CM. | |
Las pruebas de laboratorio son útiles en el diagnóstico diferencial con otros trastornos orgánicos, como, por ejemplo, la realización de coprocultivos o parásitos en heces para descartar procesos infecciosos o la serología de la enfermedad celíaca. La enfermedad celíaca se asocia con frecuencia a la CM y debe ser descartada[3]. Con respecto a los biomarcadores fecales, no existen estudios que sustenten su uso para el diagnóstico o el seguimiento de la CM. Aunque la calprotectina fecal en algunos estudios presenta unos niveles discretamente elevados en la CM frente a los trastornos funcionales, su valor predictivo es muy bajo y la guía europea desaconseja su uso[3].
La realización de una colonoscopia con ileoscopia está indicada en el estudio de una diarrea crónica[2],[3]. Los hallazgos macroscópicos de la mucosa del colon en la CM son generalmente normales cuando se realiza una colonoscopia. No obstante, hasta en cerca de un 40 % de los casos pueden encontrarse hallazgos inespecíficos como la existencia de edema, eritema, nodularidad, patrones vasculares alterados, erosiones lineales y pseudomembranas. No se han demostrado diferencias de estos hallazgos entre la CL y la CC[3].
En el contexto de una diarrea crónica acuosa con hallazgos macroscópicos normales, se considera esencial la toma de biopsias del colon, debido a que la CM es la causa más frecuente de diarrea crónica con hallazgos endoscópicos normales[2]. Además también puede diagnosticar algunos casos de colitis de Crohn o de colitis infecciosas. La toma de biopsias es coste efectivo en el contexto de una diarrea crónica acuosa y su ratio es superior a la toma de biopsias duodenales en el estudio de una diarrea, anemia o antecedentes de primer grado de enfermedad celíaca[2]. La toma de biopsias debe realizarse de manera perpendicular a la pared del colon, para facilitar la medición de la banda colágena en el caso del diagnóstico de la CC. Existe consenso en que se deben tomar biopsias en botes separados del colon derecho y del colon izquierdo. Aunque la utilidad clínica de separar dichos botes es controvertida, puede ayudar al diagnóstico dada la diferencia de celularidad en la lámina propia del colon derecho e izquierdo. Según la guía clínica española se debe tomar al menos 2 biopsias del colon ascendente, transverso, descendente y sigma[2]. En la guía europea se recomienda tomar biopsias del colon derecho e izquierdo, sin especificar la localización específica ni el número de biopsias[3].
En todos los casos de CM se recomienda descartar la coexistencia de la enfermedad celíaca. Sin embargo, no se recomienda el estudio de la malabsorción de ácidos biliares[3].
Diagnóstico histológico
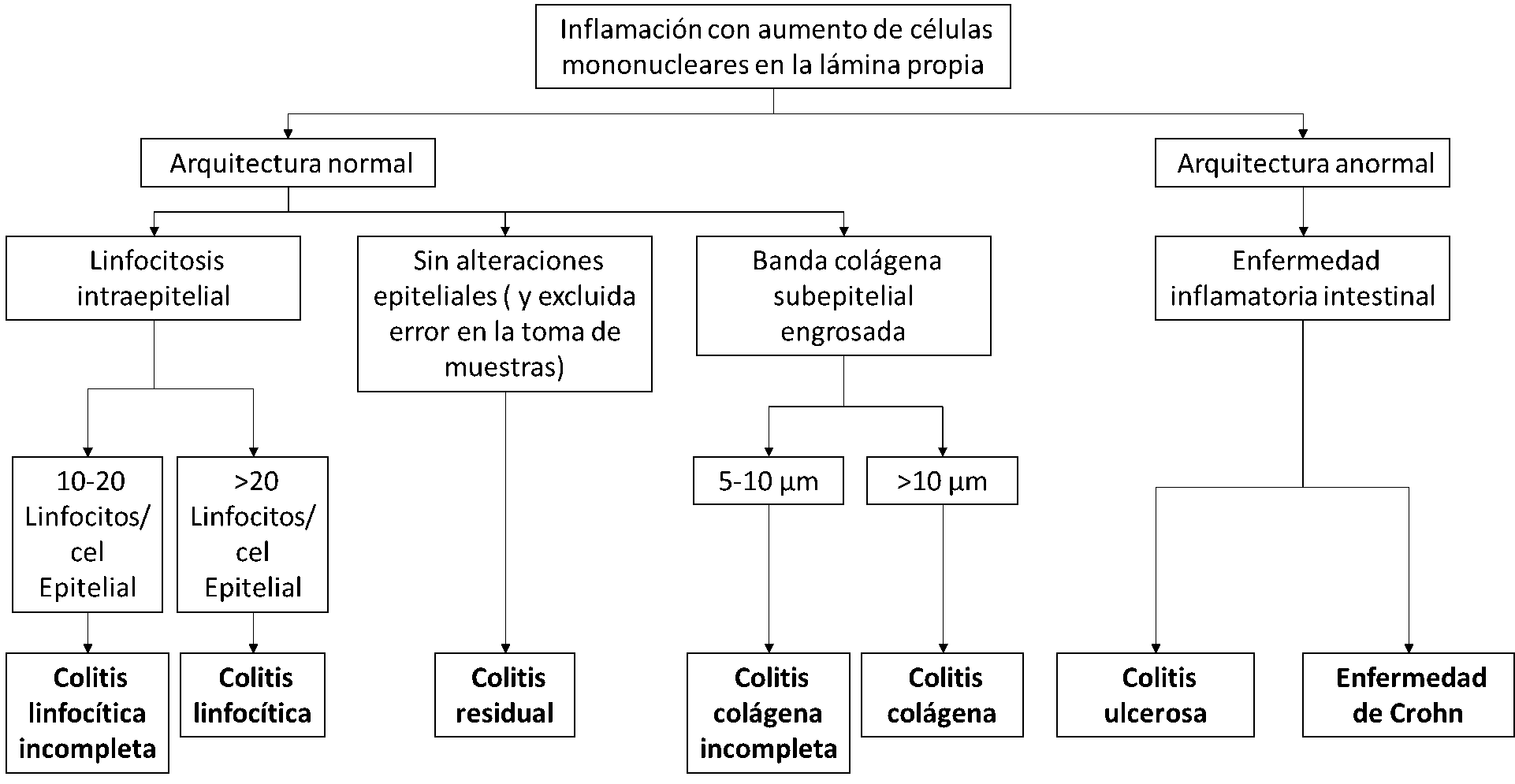
De la definición de la CM se deriva la importancia que cobra un atento estudio histológico de las muestras remitidas, teniendo siempre en cuenta las características propias de la histología del colon en cada una de sus localizaciones. La especificación de la localización es fundamental para evitar malinterpretaciones.
Los criterios histológicos para la colitis microscópica han sido establecidos con cierta rigidez, hecho que permite sospechar que no es fácil diferenciar dos cuadros con hallazgos similares, al mismo tiempo que se deduce que dichos criterios podrían cambiar en función de establecimiento de consensos que sean más rígidos o flexibles y a los que haya que adaptarse.
Los criterios son los siguientes:
Colitis linfocítica
• Linfocitosis intraepitelial (20 linfocitos intraepiteliales / 100 células epiteliales) sin distorsión arquitectural de las criptas asociada. Este contaje puede, si fuese necesario, apoyarse en la utilización de técnicas inmunohistoquímicas que pongan de manifiesto la presencia de linfocitos T en la muestra. Generalmente es el marcador CD3 el utilizado para tal fin, debiendo apostillarse que las muestras valoradas con dicha tinción terminan por obtener contajes de linfocitos T ligeramente superiores a los realizados con tinciones de rutina (hematoxilina y eosina, HE).
• Halo perinuclear linfocitario (no siempre presente).
• Cambios degenerativos o regenerativos del epitelio superficial, variable (aplanamiento, vacuolización, depleción de mucina…).
• Sólo se admite discreto engrosamiento de la banda colágena subepitelial (menos de 10 μm).
• Incremento de la celularidad en la lámina propia, con frecuente presencia de eosinófilos.
• Puede haber criptitis neutrofílica y abscesos crípticos pero la actividad neutrofílica sólo puede ser focal[10],[11].
Colitis colágena
• Engrosamiento de la banda de colágeno subepitelial a nivel superficial (mayor a 10 μm).
• El engrosamiento es más fácil de identificar entre las criptas.
• En el seno de la banda podemos encontrar capilares, hematíes y células inflamatorias.
• Mayor daño epitelial y, por tanto, desprendimiento más frecuente del epitelio de superficie.
• Puede identificarse un aumento del número de linfocitos intraepiteliales, menor y no necesario para el diagnóstico.
• Se puede recurrir a la ayuda de técnicas histoquímicas para la demostración de la banda colágena (Masson, tenascina…).
• Similares criterios a nivel de lámina propia que la CL[10],[11].
CM incompleta
• La clínica coincide con la entidad, pero la histología característica es incompleta (no se alcanza el número mínimo de linfocitos intraepiteliales o el mínimo grosor del estrato colágeno).
• Aumento del número de linfocitos intraepiteliales pero menor de 20/100.
• Aumento del grosor de la capa colágena subepitelial pero menor de 10 μm[12].
Tratamiento
El tratamiento con budesónida oral es el tratamiento de elección para alcanzar la remisión en la CM (Figura 3) . Es un tratamiento aprobado por la Agencia Europea del Medicamento, y aunque ni éste ni ningún otro está aprobado por la FDA, es el recomendado por las guías americanas, española y europea de la CM[1],[3]. Con una evidencia moderada en la CC y baja en la CL el tratamiento con budesónida consigue una respuesta clínica histológica y una mejora en la calidad de vida[3].
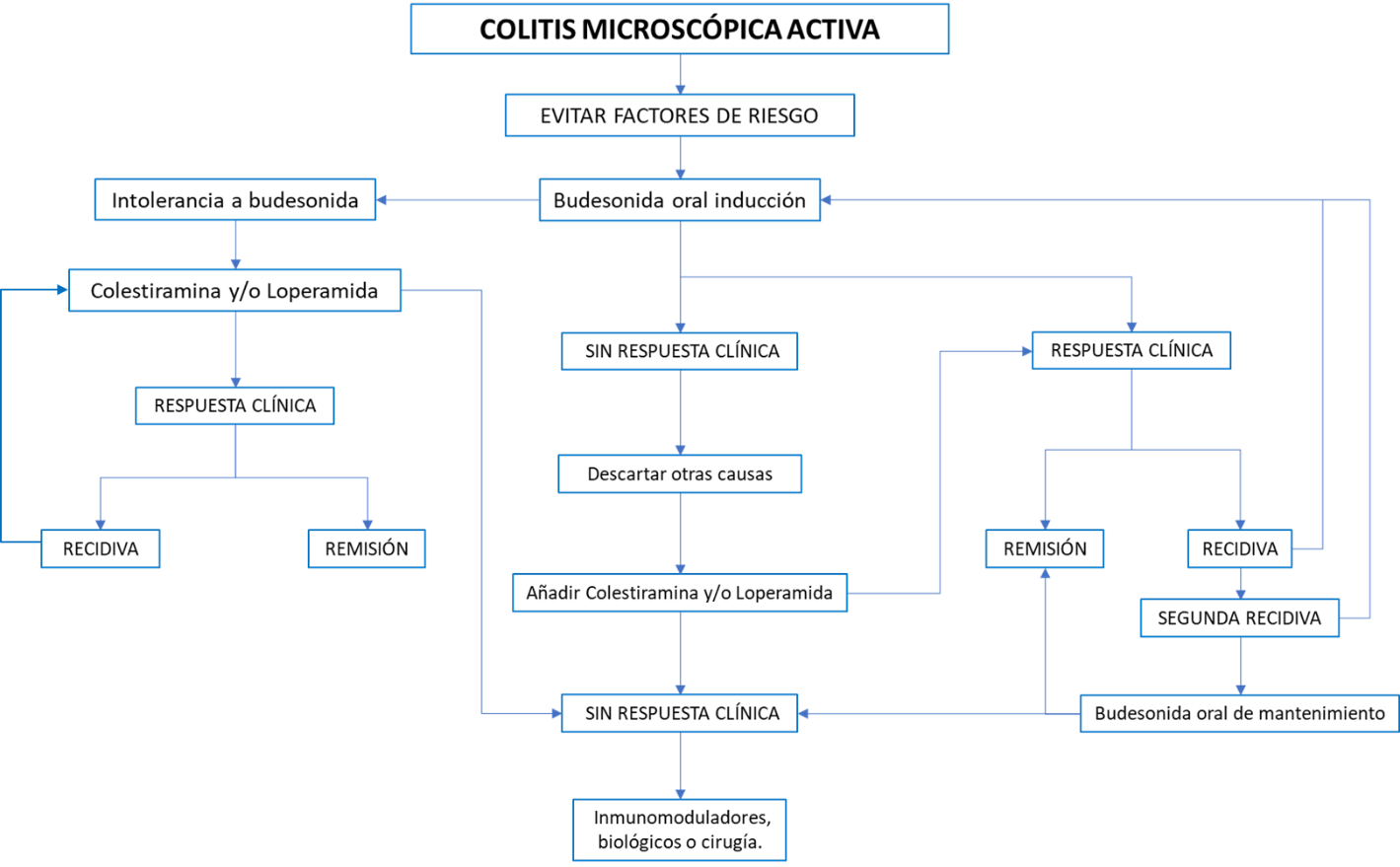
Figura 3
Esquema de tratamiento de la CM activa. Budesónida de inducción: 9 mg/24h/voral durante 6-8 semanas. De mantenimiento: 3-6 mg/24h/voral. Colestiramina: 3-4 gr/8-12h/voral. Loperamida: 2-16 mg/24h/voral.
El tratamiento de inducción se realiza a dosis de 9 mg/día por vía oral durante 6-8 semanas, con una tasa de remisión del 81% en la CC y del 95 % en la CL. No es necesaria ni la reducción de dosis progresiva, ni el uso concomitante de calcio y vitamina D[3],[13],[14]. Tampoco es necesario confirmar la respuesta histológica mediante la repetición de la colonoscopia con toma de biopsias[3].
A pesar de conseguir tasas de inducción altas, la recidiva es frecuente. Por ello, cuando se produce una segunda recidiva, tras un tratamiento de inducción, se recomienda un tratamiento de mantenimiento con budesónida, con mayor evidencia en la CC. Las dosis usadas en los estudios de investigación fueron de 6 mg/día, o alternando 3 y 6 mg cada día, siendo las recomendaciones de la guía europea intentar usar la menor dosis eficaz[2],[3]. El uso de budesónida a largo plazo es seguro. Aunque podría existir una disminución de la densidad mineral ósea con el tratamiento de mantenimiento no se ha demostrado un aumento del riesgo de fracturas, por lo que, aunque algunos autores recomiendan añadir vitamina D y calcio, especialmente si coexisten otros factores de riesgo de osteoporosis, la guía europea no lo hace[3],[13].
En los casos en los que no exista una respuesta al tratamiento de inducción con budesónida, se recomienda descartar otras causas de diarrea crónica, como la malabsorción de ácidos biliares, el síndrome de intestino irritable o la enfermedad celíaca. Además, se recomienda la suspensión del consumo de tabaco y de los fármacos que se relacionan con la CM, aunque la evidencia al respecto de estas medidas es escasa y se suele plantear al diagnóstico de la enfermedad. Cumplidas estas premisas, ante la persistencia de los síntomas, la primera medida recomendada es añadir al tratamiento colestiramina y/o loperamida. Ambos fármacos también se pueden usar en los casos leves de la enfermedad (menos de 3 dep/día, y menos de 1 deposición acuosa al día)[3],[13],
La colestiramina (3-4 gr/ 2 o 3 veces al día) ha mostrado eficacia en la remisión, especialmente cuando existe una asociación de la CM con una malabsorción de ácidos biliares. En este sentido, desde la guía europea se recomienda su uso, con baja evidencia, sólo en los casos en los que coexistan ambas enfermedades, mientras que la guía española no realiza dicha diferenciación[2],[3].
La loperamida (2-16 mg/día) no tiene estudios controlados que avalen su eficacia en la CM. Basada en series de casos, se recomienda para reducir el número de deposiciones, mejorar la incontinencia fecal y por tanto la calidad de vida. No se le atribuye ningún efecto en la patogenia de la enfermedad y se considera un tratamiento sintomático[2],[3].
No se recomienda el uso de antibióticos, probióticos, mesalazina, subsalicilato de bismuto ni otros corticoides en el tratamiento de la enfermedad[1]-[3].
Cuando no existe respuesta al tratamiento de inducción a budesónida o budesónida más colestiramina/loperamida, o al de mantenimiento con budesónida se considera una CM refractaria. En estos casos, las recomendaciones son el uso de inmunomoduladores como la azatioprina o la 6-mercaptopurina, y entre los biológicos, los fármacos anti-factor de necrosis tumoral y el vedolizumab. No se recomienda el uso de metotrexato. No obstante, la experiencia es escasa y los casos deben ser seleccionados[3].
Finalmente, la cirugía (ileostomía, sigmoidostomía, o proctocolectomía con pouch ileoanal) podría ser un tratamiento de rescate en casos muy seleccionados[3].
Conclusión
La CM es una enfermedad de incidencia y prevalencia en aumento. Aunque no se asocia a un aumento de mortalidad afecta negativamente en la calidad de vida de los pacientes. Su patogenia es desconocida y se deben producir avances en este sentido para mejorar la compresión de la enfermedad y establecer al fin, la relación entre la colitis linfocítica y colágena y su historia natural. Para el diagnóstico se sigue dependiendo de la realización de una colonoscopia con biopsias colónicas. Una línea de investigación sería la búsqueda de marcadores biológicos de la enfermedad o el desarrollo de nuevos estudios de puntuación clínicos para predecir el riesgo de CM. Esto evitaría la realización de colonoscopias y toma de biopsias en pacientes con patología funcional. Se recomienda la toma de biopsias en botes separados de colon izquierdo y derecho; aunque esta circunstancia, junto con el número de biopsias necesarias, deben aclararse en el futuro. Además, se debe determinar la historia natural y la relevancia clínica de la CM incompleta. La budesónida es el tratamiento de elección siendo frecuente la necesidad de tratamiento de mantenimiento con dicho fármaco, que tiene un buen perfil de seguridad. Serían necesarios nuevos estudios con fármacos en caso de refractariedad a budesónida.

 Descargar número completo
Descargar número completo Download full issue
Download full issue