CORRESPONDENCIA
Ángeles Pérez Aisa
Unidad de Digestivo
Agencia Sanitaria Costa del Sol
Autovía A7 Km 187, 29600 Marbella. Málaga.
Teléfono fijo: 951976746
drapereza@hotmail.com
Introducción
La enfermedad celíaca (EC) es una enteropatía autoinmune crónica precipitada por la exposición al gluten en personas genéticamente predispuestas, con anticuerpos serológicos específicos en contra de la mucosa intestinal, como son el Ac antitransglutaminasa y Ac antigliadina. Forma parte de un espectro de enfermedades de base inmunológica relacionadas con el gluten, entre los que se encuentra la alergia al gluten, la sensibilidad al gluten no celiaca y las reacciones inmunológicas relacionadas con el gluten[1]-[4].
El gluten es un complejo proteico estructural procedente del trigo cuya fracción inmunológica y tóxica son las gliadinas (proteína monomérica) y glutamina (agregado proteico)[1]. Para otros cereales también se han descrito equivalentes tóxicos al gluten, entre ellos diferentes tipos de prolaminas contenidas en estos cereales, como la secalina del centeno, la horneina de la cebada, la avenina de la avena, y híbridos como Kalmut y el triticale[5], [6]. Estas proteínas resisten la digestión y a nivel intestinal son desaminadas en la lámina propia de la mucosa dejando expuestos ciertos epítopos que son reconocidos por el HLA-DQ2 o HLA-DQ8 de los linfocitos T, que desencadenan la respuesta inmune, que da lugar a la formación de los Ac específicos de la EC[1], [3], [5].
Esta enfermedad se puede manifestar con una gran variedad de síntomas y puede aparecer a lo largo de toda la vida. Una gran cantidad de pacientes presentan poca sintomatología o se manifiesta de forma atípica con síntomas extraintestinales, siendo una minoría la que presenta la sintomatología clásica de malabsorción[7].
Actualmente el diagnóstico de EC se basa en la biopsia intestinal y presencia concomitante de serología específica para EC positiva, la segunda biopsia postratamiento hoy en día no es necesaria de forma rutinaria, y se haría solamente para aquellos en los que el diagnóstico inicial no sea concluyente o no respondieran a la dieta sin gluten. Entre los anticuerpos específicos de EC tenemos dos grupos: los autoanticuerpos: Antiendomisio (EMA) y antitransglutaminasa (tTG), y los dirigidos contra el agente agresor: Antigliadina y anticuerpos anti péptido desaminado de la gliadina (DGPs). Se basan en la inmunoglobulina A (IgA) o Inmunoglobulina G (Ig G), éstos últimos especialmente útiles en aquellos con déficit de Ig A o niños menores de 3 años, en los que se determinará la IgG tTG o IgA DGP[7], [8]. Por otra parte, la gastroscopia nos permite la toma de muestras y estudio histológico, y se realizará para la confirmación diagnóstica o en aquellos pacientes en los que la serología es negativa, pero la sospecha clínica es muy alta[7]-[9].
El tratamiento de la EC consiste en una dieta exenta en gluten. En los últimos años se han publicado estudios que demuestran la utilidad de hacer una prueba de 14 días a la exposición al gluten, ya que no todos los pacientes responden igual a la misma, y en algunos pacientes la dieta estricta sin gluten no sería necesaria[3], actualmente esta práctica quedaría reservada para pacientes con dieta libre de gluten y un diagnostico dudoso[7].
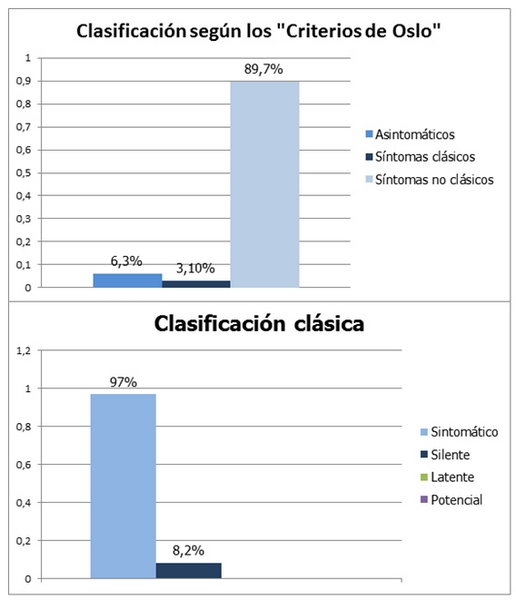
Debido a la diversidad de presentaciones de la celiaquía y a la falta de consenso en la definición de cada una de ellas, se han publicado recientemente los "Criterios de Oslo" definidos a partir de una conferencia de consenso, que agrupan a estos pacientes en 2 grupos según la presentación clínica de la enfermedad: pacientes asintomáticos y pacientes sintomáticos, que a su vez pueden presentar sintomatología clásica o no clásica (Tanto gastrointestinales como extraintestinales). Además se desaconseja el uso de términos clásicos que pudieran inducir a confusión[2].
El objetivo de este estudio es clasificar en función de los criterios de Oslo a los pacientes diagnosticados de EC desde 2008 a 2012 y compararlo con la clasificación de éstos mismos pacientes según se había hecho hasta ahora. Los objetivos secundarios fueron la valoración del uso de herramientas diagnósticas (Serología, genética e histología según la Clasificación de Marsh) y valoración del seguimiento de los pacientes con EC.
Material y métodos
Se realiza un estudio descriptivo transversal de todos los pacientes mayores de 18 años diagnosticados de EC desde enero del 2008 a diciembre del 2012, incluyendo datos demográficos, sintomatología presente, métodos diagnósticos utilizados, evolución con dieta sin gluten y seguimiento, recogiéndose los datos de la historia clínica digitalizada en HP Doctor.
Se recogieron los pacientes con biopsia positiva para celiaquía en este periodo de tiempo y se clasificaron en base a los criterios clásicos de la EC, en pacientes con enfermedad sintomática o asintomática silente, latente o potencial; y en base a los nuevos Criterios de Oslo en sintomáticos y asintomáticos potenciales.
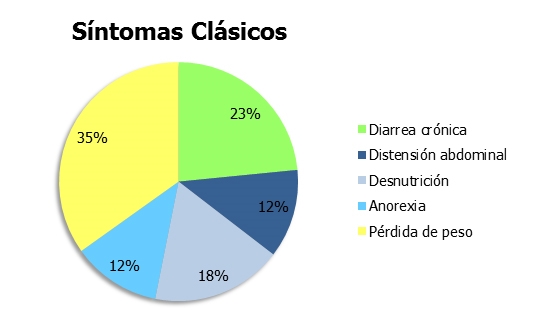
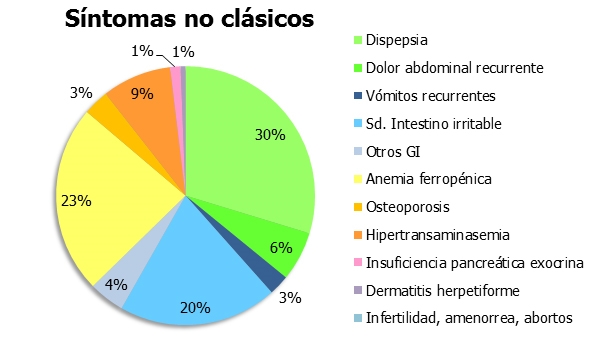
Se definieron como síntomas clásicos la diarrea crónica, distensión abdominal, desnutrición y pérdida de peso. Para los síntomas no clásicos se diferenció entre digestivos y extradigestivos. Dentro de los gastrointestinales, se incluyen la dispepsia, el dolor abdominal recurrente, los vómitos recurrentes, el síndrome de intestino irritable, y un grupo con otros síntomas digestivos. Dentro de los síntomas extradigestivos se incluyeron la anemia ferropénica, osteoporosis, hipertransaminasemia, insuficiencia pancreática exocrina, dermatitis herpetiforme, amenorrea, abortos e infertilidad (Tabla 1).
Tabla 1
Definición de los síntomas recogidos según los Criterios de Oslo.
Para el diagnóstico se recogió la positividad o negatividad a pruebas serológicas (Ac antitransglutaminasa, antigliadina y antiendomisio), a pruebas genéticas (HLA-DQ2 y DQ8), la objetivación mediante endoscopia de signos sugerentes de celiaquía (aplanamiento vellositario, mucosa en empedrado y aplanamiento de pliegues) y estudio anatomopatológico de las biopsias y clasificación según Marsh en H0, H1, H2, H3a, H3b y H3c.
Durante el seguimiento se valoró la adherencia de los pacientes a la dieta sin gluten, clasificándolos en cumplidores totales, parciales y nulos, teniendo en cuenta la pérdida de seguimiento.
Además se evaluó la presencia de complicaciones relacionadas con la enfermedad celíaca: Diabetes Mellitus tipo 1, enfermedad tiroidea autoinmune, colitis microscópica, enfermedad neurológica, déficit de IgA y otras.
Se realizó un análisis descriptivo utilizándose medidas de tendencia central y dispersión para las variables cuantitativas, y medidas de distribución de frecuencias para las cualitativas. Además, se valoró la concordancia entre los dos tipos de clasificación de la enfermedad.
Resultados
Se incluyeron un total de 97 pacientes, de ellos 33 hombres y 64 mujeres con una media de edad al diagnóstico 41,96 (±15,75). Solo un 4,1% de todos ellos tenían antecedentes familiares de EC.
Siguiendo las definiciones clásicas para la EC el 90,7% de los pacientes fueron clasificados como sintomáticos inicialmente y el 8,2% como silentes. No hubo ninguno en el grupo de latente ni potencial (Figura 1). Al clasificarlos según los "Criterios de Oslo" el 92,8% de los pacientes fueron sintomáticos al diagnóstico, presentando principalmente síntomas no clásicos (89,7%). Dentro de éstos, los síntomas gastrointestinales más frecuentes fueron la dispepsia, que se presentó en el 48,5%, y el síndrome de intestino irritable que se presentó en un 32%. Los síntomas extradigestivos más frecuentes fueron la anemia ferropénica en un 38,1% y la hipertransaminasemia en un 14,4% (Figura 2). Una minoría de pacientes presentó síntomas clásicos (3,1%) siendo el más frecuente la pérdida de peso en un 6,2%% y la diarrea crónica en un 4,1% (Figura 3).
Se realiza una tabla de contingencias para valorar la relación entre las dos clasificaciones, de forma que el 95,5% eran sintomáticos en la clasificación antigua, y sintomáticos no clásicos según los criterios de Oslo. Para el resto de grupos el número de pacientes fue escaso, y no fue valorable (Tabla 2).
Tabla 2
Tabla de contingencia entre ambas clasificaciones.
Al diagnóstico un 77,1% presentó Ac anti TG elevados, un 14,6% Ac Antigliadina y un 55,9% Ac Antiendomisio. La determinación del HLA-DQ2 fue realizado solo en 9 pacientes, siendo positivo en 6 de ellos (6,2% del total) y el HLA-DQ8 se determinó en 6 pacientes, siendo positivo en sólo 2 de ellos (2,1% del total). El signo directo más frecuentemente observado mediante endoscopia fue el aplanamiento vellositario, en el 23,7% de los pacientes, con menos frecuencia, en un 15,5% se observó la mucosa con aspecto empedrado y en un 12,4% aplanamiento de pliegues. El grado histológico Marsh 0 se vio en el 1%, el Marsh 1 en el 8,2%, el Marsh 2 en el 9,3%, el Marsh 3a en el 40,2%, el Marsh 3b en el 34% y el Marsh 3c en el 7,2%. Por otra parte, de todos los pacientes incluidos solo 2 fueron diagnosticados por cribado (Tabla 3).
Tabla 3
Resultados de las pruebas diagnósticas.
El tiempo medio de seguimiento fue muy variable, con un 32,2% de pérdidas. En aquellos con seguimiento, se observó un cumplimiento total de la dieta sin gluten en un 65,5%, un seguimiento parcial de la dieta en el 13,8% y un seguimiento nulo en el 2,3%.
Por último resaltar que de todos ellos la complicación relacionada con la EC más frecuente observada fue la enfermedad autoinmune del tiroides que se dio en 7 pacientes (8% del total).
Discusión
La EC constituye uno de los trastornos inmunológicos más frecuentes sobre todo en países europeos y norte de América, afectando entre un 0.5-1% de la población europea y estadounidense[1], [2], [10]. Se estima que en Europa el consumo medio de gluten es de unos 10-20g por persona y día, con una parte de la población que consume 50g al día o más, por ello todas las personas, incluso aquellas con bajo riesgo son susceptibles de desarrollar alguna forma de reacción al gluten durante su vida. En las últimas décadas se ha descrito una tendencia en aumento de la prevalencia, aun por causas desconocidas[11], [12]. Se cree que puede estar en relación con la occidentalización de la dieta en países que tradicionalmente el trigo no formaba parte principal de su alimentación, como por ejemplo está ocurriendo en países Asiáticos. Además también hay estudios recientes que ponen de manifiesto que esta enfermedad también es frecuente en países del norte de África, Medio Oriente y la India[1], [7], así como Asia y Centroamérica[13]. Además a pesar de ser un fenómeno común y global, el diagnóstico muchas veces se pierde o es tardío, fenómeno que se ha descrito clásicamente asemejándolo a un iceberg, ocupando su pico los pacientes con síntomas clásicos que son los que más se han diagnosticado y encontrándose en el estrado justo debajo del agua aquellos con síntomas no clásicos, y en estratos inferiores los denominados clásicamente como silente, latente o potencial[10]. En relación a esto, parece que está contribuyendo en el aumento de la prevalencia la mayor conciencia de esta enfermedad, con el reconocimiento de una variedad más amplia de manifestaciones clínicas relacionadas con este trastorno, y la mejora en las técnicas diagnósticas y de screening[7], [11].
En un estudio publicado en 2013 observan un incremento de la prevalencia de EC desde el año 2000 al 2010, siendo este aumento más acusado en los primeros años para luego estabilizarse a partir del año 2004. Describen una prevalencia del 11.1 por 100.000 persona-año entre los años 2000-2001, a un 17.3 por 100.000 persona-año entre los años 2008-2010[13]. Hay estudios previos que también objetivan un aumento de la prevalencia en los últimos años[12].
Por tanto la exposición al gluten en todo el mundo es alta y la frecuencia (en aumento) de los trastornos relacionados con el mismo también es alta, haciendo imprescindible una simplificación en las definiciones y de la clasificación de todos estos trastornos.
Han sido muchos los intentos de unificar la nomenclatura a lo largo de los últimos años. A principios del 2012, se publicó por la sociedad europea de gastroenterología pediátrica (ESPAGHAN) una serie de recomendaciones definidas por consenso, en el que intentan homogeneizar no solo la terminología relacionada con la EC, sino también las pautas diagnósticas y el tratamiento. Definen EC sintomática, aquella que se presenta con manifestaciones clínicas, con síntomas que pueden ser gastrointestinales o extraintestinales (ej. anemia, neuropatía, disminución de la densidad ósea). EC silente se define por la presencia de anticuerpos específicos de EC positivos, HLA y biopsia de intestino delgado compatible, sin síntomas suficientes para generar una sospecha clínica. EC latente, por la presencia de HLA compatible sin enteropatía, en un paciente que ha tenido una enteropatía dependiente de gluten en algún momento de su vida, pudiendo haber presentado o no sintomatología o positividad para los anticuerpos. Y EC potencial por la presencia de anticuerpos específicos positivos, HLA compatible, pero sin alteraciones en la biopsia, pudiendo haber presentado o no síntomas[4].
También en 2012 se publicó un consenso sobre la nueva nomenclatura y clasificación de la EC, donde definen todas aquellas entidades relacionadas con el gluten, clasificándolas en tres grandes grupos: la alergia al gluten, las reacciones inmunológicas relacionadas con el gluten, entre las que incluyen también afectaciones extraintestinales (la ataxia por gluten y la dermatitis herpetiforme); y la sensibilidad al gluten no celíaca[1].
La alergia al trigo es una reacción de hipersensibilidad tipo I mediada por IgE. Dependiendo del mecanismo inmunológico subyacente se pueden clasificar en alergia alimentaria, anafilaxia inducida por trigo dependiente del ejercicio, asma ocupacional y rinitis, o urticaria de contacto. Generalmente el diagnóstico de todas ellas se realiza mediante pruebas cutáneas[1], [2].
Las reacciones inmunes al gluten, engloban la ataxia por gluten, que constituye una ataxia esporádica e idiopática con serología positiva para anticuerpos antigliadina y que puede acompañarse o no de enteropatía. Esta entidad resulta de una reacción cruzada entre las proteínas del gluten y las células de Purkinje. En segundo lugar, la dermatitis herpetiforme, que es una manifestación cutánea de la enteropatía de intestino delgado precipitada por la exposición al gluten, y que se presenta con ampollas de base eritematosa muy pruriginosa, caracterizadas por depósitos de Ig A en las papilas dérmicas, y que también cursa con serología positiva para EC (Actualmente se han descrito unos anticuerpos específicos frente a la antitransglutaminasa epitelial, los TG3)[1], [14]. Finalmente dentro de este grupo se encuentra también la EC. Todas ellas con buena respuesta a la dieta exenta de gluten[1], [2].
El tercer grupo es una nueva entidad, la sensibilidad al gluten no celiaca, que constituye una reacción no alérgica ni autoinmune al gluten, de mecanismo aun no bien tipificado, en el que se produce un aumento de la permeabilidad de la mucosa intestinal sin alteraciones estructurales en la misma, con serología típica de EC y pruebas cutáneas negativas, y que por lo general su diagnóstico se realiza por exclusión. Esta entidad responde a la dieta exenta de gluten y aparece al reintroducirlo[1-3], [5], [15].
Por último, este año se ha publicado la conferencia de consenso de Oslo, en la que se intenta simplificar y clarificar toda la nomenclatura relacionada con la EC y solventar las lagunas de consenso en cuanto a sus definiciones y clasificación. En ella se analizan uno por uno los diferentes términos utilizados para la EC y se desaconseja el uso de aquellos términos que pueden inducir a confusión, recomendándose el uso de forma sistemática de aquellos bien definidos que no inducen a error, de forma que se consiga el uso de una terminología y una clasificación común para todos. De esta forma, los términos "EC típica" y "atípica" se desaconsejan, porque inducen a la idea de una mayor frecuencia de presentación, siendo paradójicamente estas formas las menos frecuentes. Son los términos "EC clásica" y "no clásica" los recomendados. En relación a la sintomatología y diagnóstico, se desaconseja el uso de "EC manifiesta", "latente", "silente" o "potencial", para recomendar el uso de "EC sintomática" o "asintomática". Para todas aquellas entidades relacionadas con el gluten aconsejan el uso de "trastornos relacionados con el gluten", y se desaconsejan el uso de "intolerancia al gluten". Para éstos trastornos se mantienen la terminología propuesta en el anterior consenso (Alergia al gluten, ataxia por gluten, dermatitis herpetiforme, EC y alergia al gluten no celiaca)[2] .
En nuestro estudio nos centramos en la EC y en los nuevos criterios propuestos en la conferencia de consenso de Oslo. Nuestros datos demuestran que las nuevas definiciones de Oslo simplifican la clasificación de la EC en dos grupos principales, sintomáticos o asintomáticos, no en cuatro como antes. Estas definiciones no incluyen datos serológicos, antomopatológicos ni genéticos, con lo que simplifican aún más y hacen más accesible su uso en la práctica habitual. Además, esta nueva forma de clasificar a los pacientes nos aporta información directa acerca de la sintomatología predominante en los mismos. Respecto a esto podemos observar que la sintomatología clásica es la minoritaria, siendo la dispepsia y el síndrome de intestino irritable las formas más frecuentes de presentación. Por último, podemos ver que la mayoría de nuestros pacientes al diagnóstico ya presentan síntomas (92%), con lo que es necesario mejorar las técnicas diagnósticas y la implementación de un screening de forma rutinaria, a pacientes con familiares de primer grado con EC para detectar a un mayor número de pacientes asintomáticos potenciales.
Tenemos que considerar varias limitaciones en nuestro estudio, entre ellas que el tamaño muestral puede resultar escaso, y por otro lado que se trata de un estudio totalmente descriptivo por lo que no se puede obtener otras conclusiones, a parte de las ya mencionadas.
En conclusión podemos decir que los Criterios de Oslo simplifican la clasificación de los enfermos con EC al no incluir datos serológicos, anatomopatológicos ni genéticos, son los datos clínicos los que definen el tipo de paciente y por ello, además de simplificar, nos permiten obtener información directa con respecto a la sintomatología predominante en cada uno de ellos, siendo la sintomatología no clásica la más frecuente y la dispepsia la principal forma de presentación. Además, al intentar definir un estándar para la terminología, permiten una clasificación que es comparable entre diferentes centros y que facilita la búsqueda bibliográfica. Revisando los datos obtenidos de nuestra muestra, debemos implementar mejoras en el proceso diagnóstico y el seguimiento de esta entidad.