CORRESPONDENCIA
Juan Jesús Puente Gutiérrez
Hospital Alto Guadalquivir
Avda. Blas Infante s/n
Andújar (Jaén) 23740
Teléfono: 953021400
jjpuente@ephag.es
Introducción
El cáncer colorrectal (CCR) es una de las neoplasias más frecuentes en países occidentales, constituyendo un problema de salud pública mundial[1]. En nuestro país, es el 3º cáncer más frecuente en hombres, tras el de pulmón y el de próstata, y el 2º en mujeres, tras el de mama, representando en 2010 el cáncer de mayor incidencia en España si sumamos ambos sexos, con una estimación de más de 25.000 nuevos casos al año[2]. Si bien la tasa de mortalidad se sitúa en torno al 40% a los 5 años, la supervivencia a largo plazo se relaciona estrechamente con el estadio en el momento del diagnóstico, mostrando tasas superiores al 90% a los 5 años para el estadio I e inferiores al 10% a los 5 años para el estadio IV[3].
El principal factor de riesgo del CCR es la edad, siendo muy infrecuente su aparición por debajo de los 50 años (<8%) e incrementándose notablemente a partir de esta edad[1], siendo este el motivo por el que se recomienda esta como la edad de inicio en los programas de cribado poblacional[4]. Más allá de esto, los antecedentes familiares de CCR constituyen el principal factor de riesgo para su aparición. En este sentido, ya desde hace años diversos estudios observacionales de casos y controles encontraron una mayor prevalencia de CCR entre sujetos pertenecientes a familias donde se había diagnosticado un caso de CCR, llegándose a la conclusión de que la aparición de un caso de CCR aumenta el riesgo de padecerlo en los familiares más directos y, además, este tiende a aparecer a una edad más temprana[5]. Otros factores de riesgo son padecer enfermedad inflamatoria intestinal de larga evolución (enfermedad de Crohn con afectación colónica o colitis ulcerosa), la obesidad, el sedentarismo, la ingesta reducida de fibra vegetal y el consumo excesivo de carnes rojas[6]. Todos estos datos nos permiten clasificar a la población general en función del riesgo de desarrollar CCR como: a) individuos de riesgo alto (aquellos con antecedentes familiares de CCR o personales de enfermedad inflamatoria intestinal crónica), b) individuos de riesgo medio (aquellos sin antecedentes de riesgo pero con edad igual o superior a 50 años) y c) individuos de riesgo bajo (aquellos sin antecedentes de riesgo y con edad menor de 50 años).
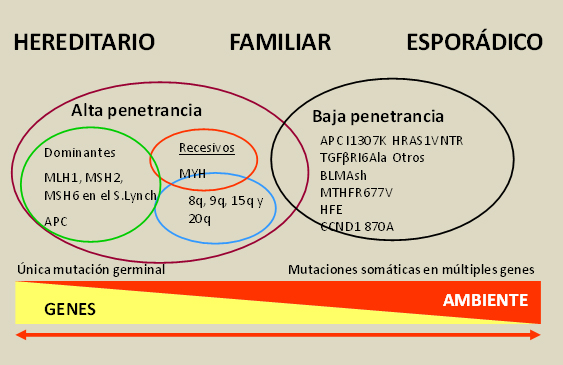
En relación con los antecedentes familiares, podemos definir 3 formas de presentación del CCR: a) forma esporádica, que constituye el 75-80% de los casos, y que corresponde a la aparición de un caso en ausencia de historia familiar; b) forma familiar (15-20% de los casos), es decir, la aparición de más de un caso en la familia sin que exista un claro patrón de transmisión hereditaria; c) forma hereditaria, que sigue un patrón de transmisión mendeliano y supone menos del 5% de los casos de CCR, comprendiendo entidades como el Síndrome de Lynch y la Poliposis Adenomatosa Familiar (PAF)[7], [8]. Estas tres formas de presentación son el resultado de la interacción de uno o múltiples genes con uno o múltiples factores ambientales a lo largo del tiempo de vida de un individuo (Figura 1). Así, está bien establecido que las formas hereditarias son el resultado de una mutación germinal en uno o varios genes dominantes de baja frecuencia y alta penetrancia (genes hMSH2 y hMLH1 en el Síndrome de Lynch; gen APC en la PAF), lo que confiere un alto riesgo de desarrollar CCR. En el otro extremo, las formas familiares y una proporción desconocida de casos esporádicos son el resultado de la interacción de diversos factores ambientales y varias mutaciones somáticas recesivas de baja penetrancia y prevalencia variable afectando a múltiples genes, muchos de ellos aún por identificar, cada una de las cuales está ligada a un riesgo bajo-moderado de cáncer pero que, en conjunto, contribuyen al desarrollo de buena parte de los casos[9].
Figura 1
La distinción entre casos hereditarios y esporádicos, y entre factores predisponentes genéticos y ambientales está mal definida, debiéndose interpretarse mejor como un continuo de factores de riesgo que contribuyen al desarrollo del cáncer colorrectal.
Las diversas manifestaciones clínicas así como los criterios diagnósticos y la genética de los síndromes de CCR hereditario no serán revisados aquí, y tampoco las estrategias de cribado. En adelante nos referiremos exclusivamente al cáncer colorrectal familiar, es decir, a la presencia de casos de CCR en la familia sin cumplirse criterios de Síndrome de Lynch ni PAF, y que, a pesar de representar sólo una quinta parte de los casos de CCR, tiene importantes implicaciones ya que un 5-11% de la población mayor de 40 años ha reconocido tener al menos un familiar de primer grado diagnosticado de esta neoplasia[10].
Por todo ello, diversas organizaciones médicas establecen a través de sus guías de práctica clínica recomendaciones específicas de cribado para los familiares de pacientes con CCR, con una estrategia de vigilancia por lo general más intensiva que la recomendada para la población de riesgo medio[4]. No obstante, son recomendaciones con base empírica pues, de un lado, no hay estudios prospectivos controlados que comparen estrategias de cribado en esta población y, de otro lado, los programas de cribado familiar están poco extendidos en la práctica clínica habitual, tanto dentro como fuera de España[11], [12].
En este artículo de revisión trataremos de responder en base a la evidencia científica disponible a las siguientes preguntas:
¿Qué riesgo de padecer CCR tienen los familiares de un individuo con CCR?
¿Por qué está justificado el cribado familiar del CCR? ¿Es coste-efectivo un programa de cribado familiar?
¿Qué medidas de cribado se recomiendan a los familiares de un paciente con CCR?
¿Qué resultados se han obtenido en los programas de cribado familiar?
¿Qué indicadores de calidad se deben atender al realizar una colonoscopia de cribado?
1. Factores de riesgo en el cáncer colorrectal familiar
La probabilidad de padecer CCR a lo largo de la vida se ha cifrado entre un 5-6% en los estudios estadísticos sobre población general[1]. A partir de aquí, hay 3 metaanálisis[13]-[15] que comprenden un amplio número de publicaciones y que demuestran que la aparición de un caso de CCR incrementa ese riesgo en los familiares entre 2-3 veces. Estas cifras se ven moduladas por diferentes variables, habiéndose identificado de manera más constante la edad de cada sujeto, el grado de parentesco, el número de familiares afectos, la edad de presentación y la localización del tumor.
Efectivamente, se han encontrado algunas diferencias en el caso de los familiares de pacientes con cáncer de recto y cáncer de colon, con diferencias no significativas en dos de los tres metaanálisis[14], [15] que sugieren algo más de riesgo en el segundo caso (RR 1,79 vs 2,20)[15].
La influencia de la edad del sujeto sobre el riesgo tiene un efecto paradójico. De un modo general, el riesgo de padecer CCR aumenta con la edad[1]-[3]. Sin embargo, en el caso del CCR familiar, la edad de presentación tiende a adelantarse unos 10 años, de forma que, en personas con un único familiar de primer grado afecto, la incidencia acumulada de CCR a los 40 años es similar a la incidencia acumulada de CCR a la edad de 50 años en sujetos sin antecedentes familiares[14]. Esto explica el que, aunque la incidencia global de CCR aumente con la edad, el riesgo relativo de CCR en los familiares decrece paradójicamente conforme aumenta la edad, siendo en promedio 3.7, 2.8, 2.1 y 1.6 a las edades de 40, 50, 60 y 70 años, respectivamente, y tiende a converger con el riesgo de la población general a partir de esta última edad[15] (Tabla 1). Es por ello por lo que la mayoría de las guías de práctica clínica recomiendan iniciar el cribado a partir de los 40 años, a diferencia de las recomendaciones para la población de riesgo medio, cuya edad de inicio son los 50 años.
Tabla 1
Riesgo de padecer cáncer colorrectal a lo largo de la vida en familiares de pacientes con cáncer colorrectal, según diversos factores de riesgo.
Por otra parte, el riesgo es mayor cuanto más estrecho es el grado de afinidad respecto del caso índice. Se consideran familiares de primer grado (FPG) a padres, hermanos e hijos; segundo grado a abuelos, tíos y sobrinos; y tercer grado a bisabuelos y primos. El riesgo es máximo en el caso de los FPG (RR 2,24)[15], si bien cuando existen familiares de segundo grado afectos este también se encuentra incrementado (RR 1,73)[14]. En el caso de los FPG, los 3 metaanálisis muestran un riesgo algo mayor cuando se trata de un hermano que cuando el familiar afecto es un progenitor, aunque sin alcanzar significación estadística. En ninguno de los metaanálisis se observaron diferencias en función del sexo. Asimismo, cuando hay más de un FPG afecto, el riesgo aumenta hasta 4[14], [15]. Además, la probabilidad de desarrollar CCR es mayor cuanto menor es la edad de diagnóstico del caso índice, de forma que aumenta hasta 3-4 veces si el CCR fue diagnosticado antes de los 50 años[14] (Tabla 1).
Finalmente, también se ha reportado un incremento del riesgo, aunque más discreto, de padecer CCR en el caso de los FPG de sujetos con al menos un adenoma de tamaño igual o mayor de 1cm [16], no así en el caso de adenomas pequeños.
2. Justificación del cribado del cáncer colorrectal familiar
Un programa de cribado consiste en la realización de uno o varios test en una población que no tiene signos ni síntomas de la enfermedad buscada, pero cuyos miembros presentan alguna característica que los identifica con un posible riesgo de padecerla, la cual puede ser mejorada por una detección y un tratamiento tempranos[17]. Antes de la puesta en marcha de cualquier programa de cribado, este debe ser evaluado teniendo en cuenta su efectividad y su eficiencia. Los principios para esta evaluación, que permiten que un programa de cribado pueda ser recomendado, fueron desarrollados por la Organización Mundial de la Salud en 1968[18]:
• La enfermedad debe ser un problema de salud pública relevante (elevada incidencia y morbimortalidad).
• Se dispone de un conocimiento suficiente de la historia natural de la enfermedad, existiendo una lesión latente o un estadio inicial, identificables en ausencia de síntomas.
• Existe un tratamiento efectivo para los pacientes con la enfermedad, el cual, aplicado precozmente, consigue mejorar el pronóstico.
• Existe un test aplicable capaz de detectar el estadio inicial o la lesión latente en la población de riesgo, válido y razonablemente seguro.
• El test debe ser fácilmente aceptado por la población.
• Existe consenso acerca de cuál es la población de riesgo.
• El programa de cribado debe ser un proceso continuo y no un proyecto que se realice una sola vez.
• Existe evidencia científica que demuestre que la supervivencia mejora en el grupo cribado, preferiblemente mediante un ensayo clínico aleatorizado.
• El coste total del programa está equilibrado económicamente con el gasto sanitario global del sistema de salud.
El CCR cumple con estas premisas. Además de ser un problema de salud pública de primer orden, se dispone de un amplio conocimiento sobre su historia natural que permite proponer la secuencia adenoma-cáncer. Su pronóstico guarda una estrecha relación con el estadio en el momento del diagnóstico y su tratamiento es notablemente distinto de un estadio a otro. Finalmente, se han diseñado ensayos clínicos para evaluar distintas estrategias de cribado y existe suficiente evidencia científica que apoya su eficacia, seguridad, aceptabilidad y coste-efectividad. Trataremos de desglosar todo esto a continuación.
2.1. HISTORIA NATURAL DEL CÁNCER COLORRECTAL
2.1.1. La secuencia adenoma-carcinoma
Aunque sólo una pequeña proporción de adenomas lo harán, la mayoría de los CCR surgen de la transformación de un adenoma preexistente en un proceso de evolución lenta, que dura habitualmente de 10 a 20 años (exceptuando los casos de Síndrome de Lynch, donde el curso puede estar mucho más acelerado). El proceso se inicia en un epitelio normal que evoluciona a un epitelio hiperproliferativo y se transforma de forma secuencial en adenoma pequeño, adenoma grande, adenoma con displasia y, finalmente, cáncer[19].
La existencia de esta secuencia adenoma-carcinoma está avalada por multitud de evidencias indirectas como el hecho de compartir epidemiología paralela (prevalencia geográfica, edad de aparición, sincronía de las lesiones, conocimiento de la secuencia en la PAF, etc.) o el hecho de presentar mutaciones similares (genes APC, p53, MMR, etc.). Pero la evidencia más importante que avala esta secuencia corresponde los estudios post-polipectomía, donde se observa que la polipectomía endoscópica disminuye la incidencia de CCR en un 76-90%[20], [21]. Así, Winawer y cols.[20] analizaron los datos procedentes del National Polyp Study entre 1980-1990 en 1418 individuos sin antecedentes de riesgo que tenían una colonoscopia completa durante la cual fueron extirpados uno o varios pólipos. La incidencia de CCR observada se comparó con tres grupos de referencia, dos cohortes retrospectivas de la Clínica Mayo y el hospital St. Mark y una muestra aleatoria del registro de población del Instituto Nacional del Cáncer, objetivándose una reducción de la incidencia de CCR de 90, 88 y 76%. Lógicamente, este y otros estudios al respecto son observacionales, ya que un ensayo clínico aleatorizado requeriría de un grupo control de sujetos que tuvieran pólipos adenomatosos histológicamente documentados pero que se dejaran in situ, para así comparar la incidencia de CCR con la de otro grupo de sujetos en el los pólipos sí fueran extirpados, lo que no es éticamente factible. Otra cuestión también relevante es si estos cánceres detectados y prevenidos con la colonoscopia tienen potencial de provocar mortalidad a largo plazo. Estos datos han sido recientemente actualizados a lo largo de un período de seguimiento de más de 23 años sobre la cohorte del National Polyp Study evaluándose el efecto de la polipectomía en la mortalidad y objetivándose una reducción del 53% en la mortalidad por CCR en la cohorte sometida a polipectomía[21].
2.1.2. El concepto de adenoma avanzado
Aunque la mayoría de los CCR surgen de la transformación de un adenoma, lo cierto es que los adenomas son muy frecuentes en la población general, señalándose una prevalencia entre 13-46%[22]-[24], mayor en los varones y también conforme aumenta la edad[25], [26]. Se piensa que sólo un porcentaje muy pequeño de estos adenomas adquiere un tamaño mayor o igual a 1cm y, de ellos, sólo algunos llegan a transformarse en cáncer. De hecho, la presencia de un solo adenoma pequeño, particularmente con histología tubular y sin displasia, no parece conferir un riesgo aumentado[27] en tanto la presencia de adenomas múltiples, sin importar su tamaño, se han asociado a un riesgo creciente de displasia o CCR en muchos estudios.
Por eso se introdujo el concepto de adenoma avanzado[28], es decir, aquel adenoma con un tamaño igual o superior a 10mm, con componente velloso (mayor del 25%) o con displasia de alto grado. Son estos adenomas los que tienen una mayor probabilidad de progresar a cáncer, estimándose una tasa de progresión entre 2,5-5,6% anual. Su prevalencia es mucho menor que la de cualquier adenoma, cifrándose 3,2-9,7% en el caso de la población de riesgo medio (Tabla 2)[23]-[26], [29]-[31], existiendo menos información al respecto en el caso de los familiares de pacientes con CCR, si bien se sabe que estos tienen un riesgo incrementado de aparición de adenomas avanzados (entre 2-3 veces) en tanto el riesgo de presentar adenomas no avanzados es similar a los sujetos sin antecedentes familiares[32]. Todos estos datos han llevado a que las estrategias de cribado del CCR estén dirigidas a detectar no sólo el cáncer precoz sino también los adenomas avanzados, consolidándose el concepto de neoplasia avanzada (adenoma avanzado y/o cáncer invasor)[25] como variable principal en la mayoría de los estudios de intervención.
Tabla 2
Prevalencia de adenomas y adenomas avanzados en individuos asintomáticos con edad igual o superior a 50 años (población de riesgo medio).
2.2. EVIDENCIAS SOBRE EFECTIVIDAD DE LOS TEST DE CRIBADO DE CÁNCER COLORRECTAL
Existen numerosas dificultades y limitaciones de orden metodológico que han venido condicionando cualquier estudio sobre efectividad del cribado de CCR. Así, el estudio ideal es el ensayo controlado y aleatorizado pero este se ve limitado por la necesidad de un gran tamaño muestral para encontrar diferencias en la mortalidad y diluir pérdidas, además de precisar un seguimiento de muchos años dada la prolongada historia natural de la enfermedad, lo que, a su vez, facilita la interacción de variables confusoras (mejoras en el diagnóstico o en los tratamientos, etc.). Por ello se ha recurrido frecuentemente a estudios de casos y controles que, si bien plantean sesgos de selección y dificultades inherentes a la recogida retrospectiva de datos, se encuentran libres de estas limitaciones. También se ha recurrido al uso de modelos matemáticos probabilísticos que, aunque puramente teóricos, predicen mortalidad y/o incidencia en función de la introducción de diversas variables cuyo valor puede ser modificado por el investigador (tales como la distinta sensibilidad/especificidad de uno u otro test), lo que los hace más flexibles e inmediatos, además de permitir un nivel óptimo de detalle.
A todas estas dificultades aplicables a cualquier estudio sobre cribado de CCR, hay que añadir la escasa extensión y sistematización de los programas de cribado familiar, lo que ha motivado que los estudios sobre prevención del CCR familiar no sean numerosos. Por tanto, las mayores evidencias disponibles sobre cribado familiar del CCR en realidad se sustentan en los datos disponibles sobre cribado en población de riesgo medio, donde se ha demostrado tanto su efectividad[4], [23], [33]-[36] como su equilibrio desde el punto de vista económico (coste-efectividad)[4], [38], centrándose la controversia en la elección de la estrategia diagnóstica más adecuada (test de sangre oculta en heces, rectosigmoidoscopia, colonoscopia, etc.).
2.2.1. Evidencias sobre cribado en población de riesgo medio
La información más amplia sobre los beneficios del cribado de CCR en población de riesgo medio procede del Minnesota Colon Cancer Study, donde Mandel y cols.[33], [34] estudiaron prospectivamente a 46.551 sujetos asintomáticos mayores de 50 años, a los que se les ofreció test de sangre oculta en heces (SOH) anual o bianual (y colonoscopia cuando alguna muestra era positiva) versus simple observación, demostrándose una reducción del 20% en la incidencia de CCR y del 33% en la mortalidad por CCR tras 13-18 años de seguimiento, con una tasa de aceptación de la colonoscopia de sólo 38%.
Del mismo modo, un amplio estudio multicéntrico británico aleatorizado, controlado y prospectivo, con un seguimiento de 12 años sobre más de 57.000 sujetos[37], demostró que la realización de una única sigmoidoscopia (y colonoscopia si esta era positiva) conseguía una reducción en la incidencia y mortalidad por CCR del 23% y 31% respectivamente en el análisis por intención de tratar, hallazgos que han sido corroborados en dos grandes estudios posteriores con diseño similar, uno italiano (34.272 sujetos)[39] y otro norteamericano (77.445 participantes)[40]. Sin embargo, está discutido el efecto de la sigmoidoscopia en la prevención de cánceres proximales pues, aun realizando colonoscopia a todos los sujetos a quienes se detecten pólipos en una sigmoidoscopia, la mitad de los casos de neoplasia avanzada proximal no serán detectados[41]. Así, en el estudio de Shoen y cols.[40] el descenso en la mortalidad por CCR obtenido fue a expensas de la localización distal, que se redujo un 50%, en tanto no se modificó la mortalidad por CCR proximal.
En cuanto a la colonoscopia, su principal aval consiste en su mayor sensibilidad diagnóstica respecto de los otros test, siendo además la técnica diagnóstica patrón oro en los estudios de cribado[4], [23], [25]. Así, el empleo de sigmoidoscopia incluso combinada con test SOH sólo ha demostrado detectar el 76% del total de casos de neoplasia avanzada comparada con la colonoscopia[23], [41]. Aunque no hay estudios randomizados que hayan demostrado que la realización de una colonoscopia periódica conduzca a una reducción en la mortalidad por CCR, sí existen amplias evidencias indirectas que lo sugieren. La primera de ellas procede del National Polyp Study, que, como ya ha sido comentado, demostró que la colonoscopia con extirpación de todos los pólipos visibles resulta en un descenso del 76-90% en la incidencia y un 53% en la mortalidad por CCR[20], [21]. En la misma línea, los estudios sobre cribado mediante la aplicación del test SOH usaban la colonoscopia para evaluar a los pacientes con el test positivo, siendo este grupo el que presentó menores tasas de incidencia y mortalidad[33], [34]. Pero también tiene inconvenientes. Sin embargo, su mayor coste (dado un mayor requerimiento de personal y tiempo, uso de sedación, mayores riesgos, etc.) y una mala opinión de la población general sobre el procedimiento, con tasas de aceptación bajas[42] han relegado a la colonoscopia frente a otros test como técnica de elección en el cribado de población de riesgo medio.
La colonoscopia virtual o colonografía por tomografía computarizada (CTC) también se ha recomendado como una alternativa a la colonoscopia convencional para el cribado de CCR con las ventajas de ser menos invasiva, no precisar de agentes evacuantes intestinales y no requerir sedación[4], [43]. Sin embargo, la exactitud de la CTC para la detección de pólipos sigue siendo controvertida, con una importante variabilidad de resultados de unos centros a otros. El metaanálisis de Chaparro y cols.[44], que abarca un total 10.546 pacientes en 45 estudios, mostró una sensibilidad global de 69%, siendo aún más baja para pólipos entre 6-9mm (60% frente a 83% para lesiones de 10 mm o más). También está aún por definir cuáles son los intervalos entre exploraciones caso de un resultado negativo, o incluso el manejo de los hallazgos positivos entre 6-9mm[4]. Otros inconvenientes son la eventual extensión del riesgo de radiación a una población asintomática, lo que conlleva aspectos éticos (el riesgo de cáncer inducido como resultado de un CTC se sitúa en 0,14% para un sujeto de 50 años[45], si bien están siendo desarrollados protocolos con menor dosis de radiación). A partir de aquí, ningún estudio randomizado prospectivo controlado se ha diseñado con el fin de demostrar la eficacia del CTC en reducir la incidencia y/o mortalidad por CCR, centrándose los estudios hasta la fecha en la detección de neoplasia avanzada como objetivo primario[43]. En cualquier caso, dado que la evidencia disponible sugiere que la CTC es comparable a la colonoscopia para la detección de cánceres y pólipos de tamaño significativo, los paneles de expertos han acordado incluir la CTC como una opción aceptable para el cribado de CCR, al menos en población de riesgo medio, si bien su uso debiera estar sujeto a estrictas normas de control de calidad[4].
Existen otros métodos diagnósticos en desarrollo como es la cápsula endoscópica colónica, cuyos dispositivos de segunda generación han mostrado una aceptable precisión diagnóstica en la detección de pólipos comparado con la colonoscopia, con una sensibilidad entre 84-89%[46], todo ello sin necesidad de sedación ni insuflación del colon, y sin que se hayan reportado complicaciones mayores. Sin embargo, no hay datos disponibles sobre su uso en el contexto de programas de cribado, señalando algunos modelos matemáticos que sólo sería una alternativa más coste-efectiva que la colonoscopia si la tasa de aceptación fuera al menos un 20% mayor, premisa que aún no ha sido demostrada[47]. Por tanto, en la actualidad, sólo se podría considerar una opción aceptable para aquellos pacientes en los que la colonoscopia no es posible[48].
En conclusión, existe evidencia disponible que apoya que cualquier estrategia de cribado aplicada sobre la población de riesgo medio puede reducir la mortalidad frente a la opción de no hacer nada. A partir de aquí existe una gran controversia acerca de cuál es la mejor estrategia a seguir; en primer lugar porque existe una gran variabilidad en el diseño, objetivos y resultados de cada estudio; en segundo lugar porque no existe consenso ni sobre el nivel de riesgo asumible ni sobre la magnitud de reducción del riesgo razonable (así, si se quiere reducir la posibilidad de falsos negativos, la opción sería la colonoscopia, pero si se quiere primar la disponibilidad, costes, seguridad, etc. entonces sería mejor opción el test SOH). Por todo ello, en la práctica, las recomendaciones de cribado se han ido estableciendo por consenso, centrándose los sistemas sanitarios en extender a la población el uso periódico de cualquiera de las técnicas recomendadas.
2.2.2. Evidencias sobre cribado en población de riesgo alto (cribado familiar)
Hay escasa información prospectiva sobre los efectos del cribado familiar del CCR. Sin embargo, teniendo en cuenta la existencia de amplia evidencia sobre los beneficios del cribado aplicado a la población de riesgo medio, cabe pensar que la sistematización en el empleo de cualquiera de los test de cribado en una población de alto riesgo debe tener un beneficio igual o mayor en términos de reducción en incidencia y mortalidad.
El estudio de seguimiento más amplio llevado a cabo en familiares es el estudio de Dove-Edwin y cols.[49], se trata de un estudio observacional prospectivo llevado a cabo en el Hospital de St. Mark en 1678 individuos con al menos un FPG diagnosticado de CCR, a lo largo de un período de seguimiento de 16 años. Este estudio mostró que la realización de una colonoscopia cada 5 años conseguía reducir la incidencia (92%) y la mortalidad (81%) por CCR respecto de la incidencia esperada en ausencia de vigilancia, siendo su principal limitación la falta de un robusto grupo control.
Acerca de otras opciones de cribado familiar existe mucha menos información. Un reciente estudio piloto multicéntrico español[50] sobre 116 FPG asintomáticos que aceptaron hacerse simultáneamente colonoscopia y test SOH inmunológico sugiere que la investigación con una sola determinación del test (seguido de colonoscopia si este es positivo) podría detectar la mayoría de los adenomas avanzados. La sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo del test SOH fueron 83, 91, 53, y 98%, respectivamente. De esta forma, cuando el test era positivo, sólo era necesario realizar colonoscopia en 2 familiares para encontrar neoplasia avanzada, y, a la vez, su elevado valor predictivo negativo podría permitir ahorrar la realización de un buen número de colonoscopias innecesarias. No obstante, está por ver si la elevada tasa de aceptación del test (86%) así como las condiciones del estudio son extrapolables, siendo precisos estudios más amplios y con familiares de mayor riesgo (la mayoría tenían un único FPG afecto diagnosticado después de los 60 años) que confirmen estos hallazgos.
En el caso particular del empleo de CTC en el cribado de CCR familiar el único estudio disponible es un estudio multicéntrico italiano[51] sobre 1103 participantes, de los que 373 tenían antecedentes familiares de CCR en al menos un FPG, a los que se realizó CTC y colonoscopia el mismo día, encontrándose una sensibilidad para neoplasia avanzada del 85% y un valor predictivo negativo del 96,3%, siendo una vez más el punto más débil la sensibilidad para adenomas avanzados entre 6-9mm, que fue sólo del 57%.
2.3. ANÁLISIS COSTE-EFECTIVIDAD DEL CRIBADO DEL CÁNCER COLORRECTAL
El coste total de cualquier programa de cribado debe estar equilibrado económicamente con el gasto sanitario global de un sistema de salud. En este sentido, los estudios sobre análisis coste-efectividad son herramientas muy útiles de cara a la planificación previa a la implementación de un programa de cribado en una población por un sistema de salud. De un modo general, el análisis coste-efectividad compara los costes asociados a la implementación de diferentes estrategias de cribado (organización, infraestructura, pruebas diagnósticas, complicaciones, etc.) frente al beneficio obtenido o esperado, medido en forma de años de vida ganados. Además se incluyen los costes asociados al diagnóstico y tratamiento de los nuevos casos de cáncer que aparecerán en uno u otro supuesto y que, en el caso de no implementar estrategia alguna de cribado, se corresponde con el coste de asumir la historia natural y diagnosticar y tratar cuando aparecen los síntomas de la enfermedad[52] (Figura 2). A partir de aquí, la consideración de cuál es la estrategia más coste-efectiva depende del precio que se esté dispuesto a pagar por los años adicionales de vida ganados.
Figura 2
Balance en el análisis de costes de los estudios coste-efectividad. En el análisis coste-efectividad de un programa de cribado, se introducen tres variables fundamentales: el coste que requiere la implementación del programa, el coste derivado del diagnóstico, tratamiento y cuidados de los pacientes que presentarán la enfermedad que se quiere prevenir, y el resultado obtenido en forma de años de vida ganados.
Debe tenerse en cuenta que los sistemas sanitarios han de emplear una importante cantidad de recursos en la asistencia de los pacientes nuevamente diagnosticados de CCR. En Estados Unidos, se ha estimado que el coste asociado al diagnóstico, tratamiento y cuidados de los pacientes con CCR cubiertos por Medicare aumente entre 53-89%, pasando de 7.490 millones de dólares en el año 2000 a más de 14.000 millones en 2020[53]. Esto se justifica por la progresiva mejora en la supervivencia de estos pacientes, entre otros motivos debido a la introducción de tratamientos cada vez más efectivos pero cada vez más caros, lo que conlleva aún mayores incrementos en los costes.
Los estudios disponibles han encontrado de forma consistente que el cribado del CCR en población de riesgo medio es coste-efectivo comparado con el no cribado, para todas y cada una de las estrategias evaluadas (test de SOH anual, bienal, sigmoidoscopia cada 5 años sola o combinada con test SOH anual, colonoscopia cada 10 años), siendo para todos los modelos menor de 60.000 dólares por año de vida ganado y situándose en su mayoría entre 10.000-25.000 dólares[54]. Es más, existe una tendencia hacia costes más favorables del cribado en los años más recientes, ya que el gasto asociado al diagnóstico, tratamiento y cuidados de los pacientes con CCR es mayor[52]-[54]. Por otra parte, ninguna estrategia individualmente se ha encontrado de forma consistente como la más coste-efectiva para un presupuesto dado[52]. Estos costes por año de vida ganado para el CCR son comparables a los de otras intervenciones como el cribado de cáncer de mama mediante mamografía a partir de los 50 años.
Desde el punto de vista del cribado familiar, un estudio estadounidense reportó que el coste de un programa de cribado familiar con colonoscopia a partir de los 40 años oscilaba en torno a 18.000 dólares por año de vida ganado frente a no hacer nada, y entre 18.000-51.000 dólares por año de vida ganado (dependiendo de la pauta de vigilancia utilizada) frente al cribado universal con colonoscopia a partir de los 50 años, llegando a ser incluso más coste-efectiva la periodicidad cada 5 que cada 10 años[55]. Mucho más cercano y basado en nuestro modelo de gestión sanitaria es el trabajo de Ladabaum y cols.[56], quienes diseñaron un modelo de decisión analítica de Markov basado en un programa de cribado familiar en la Comunidad Autónoma de Aragón. Se asumió una población diana de 49.925 sujetos entre 40-75 años con antecedente de CCR en al menos un FPG (un 8% de la población censada) y se compararon las estrategias de realizar colonoscopia cada 5 años, cada 10 años y no hacer nada. Según este modelo, la introducción de un programa de cribado familiar reduciría la incidencia de CCR entre 72-77%. A pesar de que se incrementaría sustancialmente la demanda de colonoscopia, el cribado resultó ser menos costoso que no hacer nada (3.360.000 € frente 1.451.000 €), obteniéndose entre 123-132 años de vida ganados por cada 1.000 familiares cribados. Por tanto, el cribado familiar sería coste-ahorro (más que coste-efectivo) comparándolo con no hacer nada, en tanto el cribado con colonoscopia cada 5 años costaba 7.250 € más por año de vida ganado respecto de cada 10 años. Estos resultados sugieren que el cribado familiar de CCR mediante colonoscopia puede ser coste-efectivo en un sistema sanitario público como el nuestro, siendo probable que produzca beneficios clínicos significativos a un coste aceptable.
3. Recomendaciones de cribado dirigidas a los familiares de pacientes con cáncer colorrectal
Diversas guías de práctica clínica americanas y europeas vienen recomendando pautas específicas de cribado para los familiares de pacientes diagnosticados de CCR[4], [57], [58]. La diferencia entre ellas radica fundamentalmente en el carácter más restrictivo de unas frente a otras. Como ya ha sido analizado, todas estas recomendaciones tienen una base empírica y se han establecido por consenso, dada la ausencia de estudios controlados prospectivos con objetivos primarios de incidencia y mortalidad. Las estrategias recomendadas varían según el riesgo de padecer CCR. Así, las familias con síndromes hereditarios con muy alto riesgo (Síndrome de Lynch y PAF) deben seguir programas intensivos y específicos, en tanto en el caso de las familias que no cumplen esos criterios las recomendaciones son más laxas, aunque siguen siendo más intensivas que las propuestas para la población de riesgo medio, y siempre de acuerdo con estas premisas: 1) inicio del cribado a una edad más temprana; 2) intervalos de seguimiento más estrechos; 3) uso de la colonoscopia como técnica diagnóstica de primera elección, particularmente en los sujetos con mayor carga familiar.
Una vez más hemos de remarcar que, aunque la colonoscopia se considera la prueba preferible en esta población de alto riesgo, no existe evidencia científica directa que apoye esta recomendación, no existiendo estudios controlados que comparen la eficacia de la colonoscopia frente a otras técnicas en individuos con antecedentes familiares del CCR. Por tanto, esta recomendación se basa en su consideración como estándar de oro para evaluar a los pacientes con test positivo y en el hecho de que la colonoscopia permite la extirpación de la mayoría de las lesiones detectadas, lo que reviste especial importancia en un grupo de alto riesgo de presentar cáncer y/o adenomas avanzados, como es el de los familiares de pacientes con CCR. Por contra, la colonoscopia no deja de tener algunos inconvenientes respecto de otras pruebas diagnósticas, como son su mayor coste, mayor tasa de complicaciones, necesidad de sedación y una baja tasa de aceptación, inferior al 40% incluso en población de alto riesgo [59], [60].
Recientemente las sociedades American Cancer Society, el American College of Radiology y la US Multi-Society Task Force on Colorectal Cancer (en representación de American Gastroenterological Association y la American Society for Gastrointestinal Endoscopy) han consensuado y unificado recomendaciones sobre cribado y vigilancia para el diagnóstico precoz del CCR, incluyendo un apartado sobre familiares de pacientes con CCR[4]. En la misma línea, adaptada a nuestro medio y con una excelente calidad metodológica, se encuentra la Guía de Práctica Clínica de Prevención del Cáncer Colorrectal de la Asociación Española de Gastroenterología, la Sociedad Española de Medicina Familiar y Comunitaria y el Centro Cochrane Iberoamericano[57], que incluye un apartado sobre CCR familiar y recomendaciones específicas de cribado. A continuación se resumen dichas recomendaciones, que son aplicables siempre y cuando no se cumplan los criterios de CCR hereditario (Síndrome de Lynch y PAF):
- Individuos con al menos un FPG (padres, hermanos e hijos) con CCR:
• Si son 2 o más FPG con CCR, se recomienda colonoscopia cada 5 años a partir de los 40 años de edad (ó 10 años antes de la edad de diagnóstico del familiar afecto más joven, lo primero que ocurra).
• Si es un solo FPG con CCR, la recomendación depende de la edad a la que fue diagnosticado: ◦
Si la edad de diagnóstico es inferior a 60 años, se recomiendan las mismas medidas de cribado que en el caso anterior.
◦ Si la edad de diagnostico es igual o superior a los 60 años, se recomiendan las mismas medidas de cribado que las propuestas para la población de riesgo medio (test SOH anual, sigmoidoscopia cada 5 años, colonoscopia cada 10 años) pero iniciándolas antes, a los 40 años de edad.
- Individuos sin un FPG con CCR pero con al menos un familiar de segundo grado (abuelos, tíos, sobrinos) afecto:
• Si son 2 o más familiares de segundo grado con CCR, se recomienda el mismo cribado que el propuesto para la población de riesgo medio, pero iniciándolo antes, a los 40 años de edad.
• Si es un único familiar de segundo grado con CCR, el cribado recomendado es el mismo que el propuesto para la población de riesgo medio (inicio a partir de los 50 años).
- Individuos sin familiares de primer ni segundo grado con CCR pero con al menos un familiar de tercer grado (bisabuelos, primos) afecto:
◦ El cribado recomendado es el mismo que el propuesto para la población de riesgo medio (inicio a partir de los 50 años).
4. Resultados de los programas de cribado familiar del cáncer colorrectal
4.1. EVIDENCIA DISPONIBLE
A pesar las recomendaciones de las guías de práctica clínica, que apoyan la implementación de programas de cribado específicos en FPG pacientes con CCR[4], [57], [58], lo cierto es que estos están poco extendidos y sistematizados. A día de hoy es escaso el número de estudios disponibles sobre cribado familiar y su tamaño muestral suele estar muy por debajo de los estudios sobre cribado en población de riesgo medio. Tampoco existen estudios prospectivos controlados que comparen diferentes estrategias de cribado en esta población.
La tabla 3 resume los principales estudios que existen hasta la fecha sobre cribado en familiares de primer grado de pacientes con CCR. Estos trabajos han comunicado tasas de neoplasia avanzada entre 7,5-21,3%[32], [49-51], [60]-[62], por encima de la prevalencia comunicada en población de riesgo medio[23]-[26,29-31]. Las tasas de cáncer invasivo se han situado entre 0 y 3,2%. Nos parece destacable que las diferencias se producen a pesar de que la población diana en el cribado familiar suele ser más joven que la población de riesgo medio, dado que la edad de inicio recomendada es al menos 10 años antes en el primer caso (40 años) que en el segundo (50 años)[63], [64]. Así, Armelao y cols.[61], en un reciente estudio italiano en 550 FPG, la muestra más amplia obtenida hasta hoy, encontraron tasas de adenoma del 34,0% y de neoplasia avanzada del 8,8%, respectivamente. El trabajo que mostró mayor tasa de neoplasia avanzada fue el de nuestro grupo (21,3%), sobre una muestra de 263 FPG, y que será comentado más adelante[62]. Sólo un trabajo ha evaluado el impacto de la detección y extirpación de estas lesiones en la incidencia y mortalidad por CCR, aunque sin poder establecer comparación con un grupo control. Se trata del estudio de seguimiento llevado a cabo en el Hospital de St. Mark en Reino Unido sobre 1678 FPG[49]. Tras un período de seguimiento de 16 años, se encontró que la realización de una colonoscopia cada 5 años conseguía reducir la incidencia (92%) y la mortalidad (81%) por CCR respecto de la incidencia esperada.
Tabla 3
Prevalencia de lesiones con histología avanzada en familiares de primer grado de pacientes con cáncer colorrectal.
Por otra parte, llama la atención la elevada proporción de pólipos entre 6-9mm que presentan histología avanzada (componente velloso y/o displasia de alto grado) en los estudios sobre cribado familiar, entre 35-40,5%[51], [62], muy por encima de la tasa para pólipos de igual tamaño en población de riesgo medio (3,8-10,7%)[43], [65]-[67], lo que apoya la necesidad de utilizar técnicas de cribado con suficiente sensibilidad para diagnosticar pólipos de este tamaño, particularmente la colonoscopia ya que permite su extirpación. No obstante, la historia natural los adenomas menores de 1cm es incierta y no está claro a día de hoy si los pólipos pequeños con histología avanzada tienen una capacidad de progresión a cáncer en la misma medida que los pólipos mayores, entre otros motivos porque no hay estudios que hayan valorado el impacto de la detección y extirpación de estas lesiones en la posterior incidencia de CCR.
Entre las variables asociadas a una mayor probabilidad de encontrar neoplasia avanzada durante el cribado familiar se han encontrado invariablemente la edad del cribando por encima de los 50 años y el sexo masculino[16], [25], [32], [60-62], [68,69]. Otras variables implicadas, aunque de forma más inconstante, han sido el diagnóstico de CCR a una edad temprana, el número de casos de CCR en la familia, el número de generaciones afectas, el parentesco hermano o incluso la localización distal frente a la proximal[16], [32], [60], [61], [69].
4.2. NUESTRA EXPERIENCIA
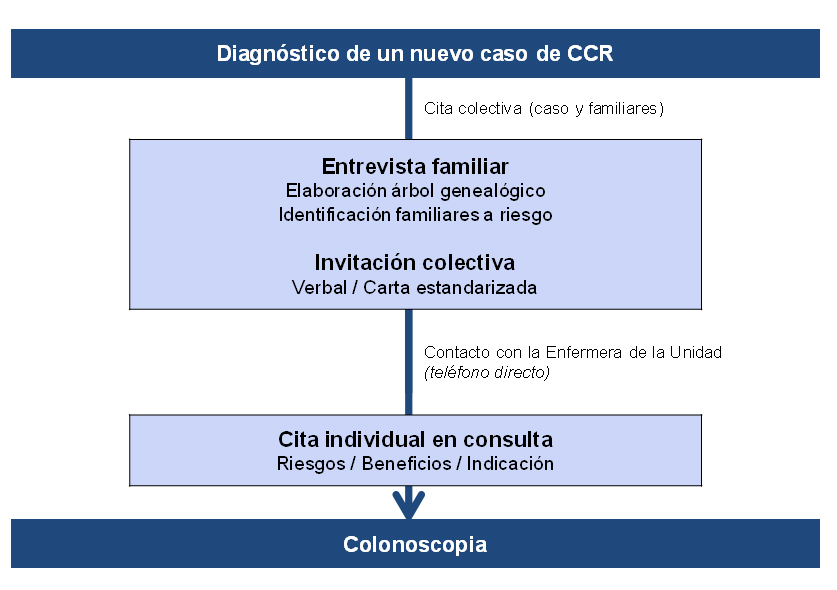
En el Hospital Alto Guadalquivir de Andújar hemos puesto en marcha un programa de prevención secundaria basado en la búsqueda activa, información y propuesta de cribado dirigido a los FPG de pacientes con CCR. Así, cuando un paciente es diagnosticado de CCR, él y su familia son citados a través de un circuito específico en la consulta de cribado para elaborar el árbol genealógico familiar, analizar el riesgo familiar e identificar a los familiares a riesgo, a quienes se propone de forma individualizada (verbalmente y mediante un carta personalizada) cribado mediante colonoscopia (Figura 3).
Figura 3
Circuito de la consulta de cribado familiar de cáncer colorrectal en el Hospital Alto Guadalquivir de Andújar.
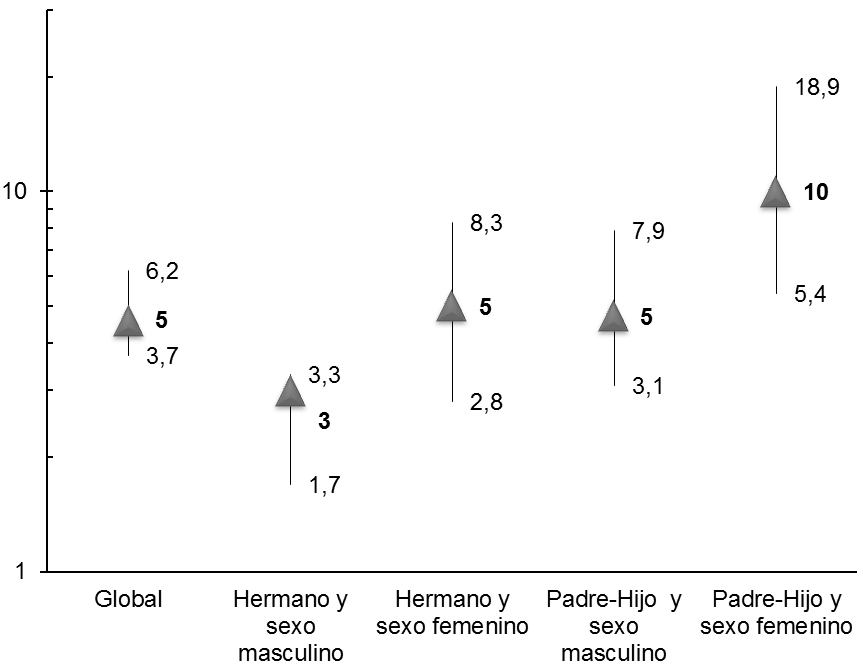
La experiencia de este programa fue publicada recientemente[62]. Desde principios de 2007 hasta abril de 2010 fueron estudiadas 138 familias, identificándose 618 FPG con edad de riesgo de padecer CCR. Previamente habían sido excluidos aquellos individuos cuya edad superaba los 75 años, aquellos que referían síntomas sugestivos de enfermedad colónica y aquellos que ya estaban en vigilancia por cáncer o adenoma colorrectal. A todos ellos se les facilitó información con una recomendación individualizada de cribado mediante colonoscopia, aceptando el 46,3% (263 familiares). Se encontró neoplasia avanzada en el 21,3% (19,4% correspondía a adenomas avanzados y 1,9% a carcinoma invasor) (Tabla 4), lo que se corresponde con un número necesario para diagnosticar (NND) de sólo 5 colonoscopias. Estos hallazgos, con una elevada tasa de familiares con al menos un adenoma avanzado en la colonoscopia, apoyan el que un programa de cribado familiar pueda ser efectivo a la hora de prevenir el CCR. Por otra parte, todos los cánceres invasores detectados, a excepción de uno, fueron estadio I de la clasificación TNM (tres pólipos Haggitt I y uno Haggitt IV), en los que la polipectomía o la cirugía están asociadas con un pronóstico excelente. Aunque encontramos una mayor proporción de neoplasia avanzada entre sujetos mayores de 50 años, el análisis multivariante identificó como únicas variables predictoras de encontrar neoplasia avanzada en la colonoscopia el sexo masculino y el parentesco hermano. Combinando estas variables encontramos que el NND entre los hermanos-varones fue 3, en contraste con las hijas-mujeres cuyo NND fue 10 (Figura 4), lo que sugiere que, una vez alcanzada la edad recomendada para el inicio del cribado, los esfuerzos de cribado podrían ser más rentables en hombres y en hermanos, donde el riesgo parece ser mayor.
Tabla 4
Hallazgo histológico más relevante encontrado en cada individuo sometido a colonoscopia de cribado en el Hospital Alto Guadalquivir de Andújar.
Figura 4
Número necesario de colonoscopias de cribado (e intervalo de confianza 95%) para detectar neoplasia avanzada, combinando las variables sexo y parentesco respecto del caso índice. Se obtuvo significación estadística en la comparación entre los grupos parentesco hermano y sexo masculino vs parentesco padre-hijo y sexo femenino.
5. Calidad en colonoscopia de cribado
Por último, queremos hacer mención acerca de una serie de connotaciones sobre la colonoscopia de cribado, ya que se trata de una prueba realizada con un objetivo principalmente preventivo a individuos sanos y asintomáticos, a quienes en muchos casos habremos invitado por nuestra propia iniciativa. Este hecho tiene una especial relevancia porque obliga a extremar la calidad de la colonoscopia a la que se somete el sujeto que acepta el cribado y, por tanto, hace imprescindible la presencia de controles y programas de mejora continua de la calidad.
El concepto de calidad de la colonoscopia abarca diferentes aspectos que se interrelacionan y complementan entre sí, a saber:
Calidad científico-técnica, es decir, la capacidad técnica en la realización de la colonoscopia, aplicando los conocimientos más recientes. Particularmente en nuestro caso se trata de detectar todas las lesiones, extirparlas de forma completa y recuperarlas para estudio anatomopatológico. Debemos tener en cuenta que el resultado de la colonoscopia de cribado condicionará la posterior estrategia de vigilancia de ese sujeto, lo cual tiene especial trascendencia a la hora de evitar cánceres de intervalo. A esto hay que añadir la necesidad de minimizar molestias y, por tanto, ofrecer sedación a todos los pacientes.
Seguridad del paciente, es decir, minimizar riesgos derivados de la realización de la colonoscopia (incluyendo polipectomías y sedación), a la vez que maximizar la información que recibe el paciente en este aspecto.
Accesibilidad, es decir, evitar barreras que impidan el acceso de la población a la colonoscopia, lo que incluye tiempos de espera, proximidad al domicilio de las unidades de endoscopia, acceso a los circuitos de información, etc. También es esencial evitar que la implementación de un programa de cribado pueda provocar incrementos en la demora de la colonoscopia de los pacientes sintomáticos, siendo recomendable la utilización de una agenda independiente.
Satisfacción del paciente, alcanzando o superando sus expectativas a lo largo de todo el proceso.
Eficiencia, es decir, lograr el máximo nivel de calidad con una utilización óptima de los recursos, que deben estar equilibrados con el gasto sanitario global del sistema de salud.
Se han publicado diversas guías sobre calidad en colonoscopia, basadas tanto en la evidencia disponible como en recomendaciones de expertos[70], [73]. Estas guías identifican diversos elementos que intervienen antes, durante y después de la colonoscopia, que influyen decisivamente en la calidad de la misma y que son susceptibles de ser monitorizados en un programa de mejora continua de la calidad. Invitamos a la lectura de la Guía de Práctica Clínica de Calidad en la Colonoscopia de Cribado del Cáncer Colorrectal elaborada por la Asociación Española de Gastroenterología y la Sociedad Española de Endoscopia Digestiva[73], que describe con detalle muy diversos aspectos teóricos y prácticos sobre calidad en colonoscopia de cribado, a la vez que propone una serie de indicadores (estándares avalados por suficiente evidencia científica), resultados auditables (resultados medibles pero con insuficiente evidencia científica que los avale) y requisitos mínimos que deben cumplir tanto las unidades de endoscopia como los endoscopistas que participen en un programa de cribado (Tabla 5). Paralelamente ofrece, con un enfoque eminentemente práctico, información de cómo se puede mejorar cada uno de estos estándares de calidad, pudiéndose extrapolar, a nuestro modo de ver, buena parte de estas recomendaciones a cualquier colonoscopia, no necesariamente en el contexto de un programa de cribado.
Tabla 5
Estándares de calidad propuestos por la Guía de Práctica Clínica de Calidad en Colonoscopia de Cribado del Cáncer Colorrectal de la Asociación Española de Gastroenterología y la Sociedad Española de Endoscopia Digestiva73.
6. Conclusiones
A modo de conclusión, creemos que toda esta información debe animar a la extensión de los programas de cribado en este grupo poblacional de alto riesgo como es el de los familiares de primer grado de pacientes con CCR. La prueba diagnóstica de elección es, hoy por hoy, la colonoscopia, dada la elevada tasa de adenomas avanzados en esta población y la alta rentabilidad diagnóstica de la colonoscopia que, además, permite la extirpación completa de la mayoría de las lesiones.Serán necesarios nuevos datos que ayuden en el futuro a optimizar las estrategias de cribado basadas en la presencia o la ausencia de determinadas variables de riesgo. En vista de la evidencia actual disponible consideramos que:
En la historia clínica de cualquier individuo debe recogerse la presencia de antecedentes familiares de CCR en al menos 2 generaciones.
El número de familiares afectos, el grado de parentesco y la edad en el momento del diagnóstico de CCR son las principales variables que determinan la estrategia de cribado y vigilancia en esta población.
Se debe recomendar cribado mediante colonoscopia a los familiares de primer grado de pacientes con CCR a partir de los 40 años (ó 10 años antes de la edad de diagnóstico del familiar afecto más joven, lo primero que ocurra).