CORRESPONDENCIA
Álvaro Giráldez Gallego.
Servicio de Aparato Digestivo
Hospitales Universitarios Virgen del Rocío
Avda. Manuel Siurot, s/n, 41013, Sevilla.
Teléfono fijo: 955012041
giraldezg@hotmail.com
Introducción
La gran mayoría de los casos de trombosis portal (TP) se relaciona con una enfermedad hepática subyacente o con tumores hepáticos o abdominales, primarios o metastásicos. Concretamente, la cirrosis hepática constituye la causa subyacente de entre un 22 y un 32 % de los casos de TP[1]-[3]. Una situación distinta es la trombosis portal no cirrótica no tumoral (TPNCNT), que supone globalmente un tercio de los casos y la segunda causa más frecuente de TP[4].En medio de estas dos circunstancias previas podríamos situar la hipertensión portal (HTP) no cirrótica, que se conoce que puede complicarse con una TP con bastante frecuencia, variable según las series: entre el 13 y el 46%[5], [6].
En el contexto de la enfermedad hepática crónica se conocen ciertas peculiaridades (relacionadas con su frecuencia, etiología, significado, pronóstico y, consecuentemente, con su manejo) que obligan a separar esta situación de los restantes escenarios en los que se puede desarrollar una TP. Estas características distintivas, tanto en su forma aguda como en la crónica, son las que desarrollaremos brevemente en esta revisión, con las limitaciones derivadas de la ausencia de estudios prospectivos que contesten a la mayor parte de las cuestiones que se plantean. A partir de ahora nos referiremos, pues, exclusivamente a la TP que se desarrolla en el contexto de una enfermedad hepática subyacente.
¿El desarrollo de la trombosis portal es un evento frecuente en la cirrosis?
Casi todos los estudios publicados que han intentado contestar a esta pregunta han evaluado prevalencia y ésta ha mostrado valores muy variables, dependiendo de las técnicas diagnósticas empleadas y de la inclusión o no de pacientes descompensados y/o con carcinoma hepatocelular (CHC). La prevalencia comunicada, pues, ha oscilado entre un 0,6%[7], en una serie japonesa de 708 pacientes con cirrosis sometidos a angiografía; y hasta un 44%, en 72 pacientes con cirrosis y CHC sometidos a autopsias[8].
En otras series de pacientes cirróticos sin CHC la detección de la TP se ha basado en la ecografía y la prevalencia ha oscilado entre el 8 y el 24,3%, dependiendo respectivamente de si se usaban técnicas adicionales (angio-TC, angio-RM y/o angiografía) confirmatorias[9]-[11] o no[12]. Quizá la información que se derivó de estos estudios sea la más relevante desde el punto de vista práctico puesto que la secuencia diagnóstica empleada en la investigación de la TP en esas cohortes de pacientes fue similar a la utilizada habitualmente en la clínica. Estos mismos estudios mostraron diferencias ostensibles en la prevalencia entre población cirrótica compensada -tan baja como del 1%-[10] y descompensada -en espera de trasplante hepático (TH), con o sin CHC-, donde se documentó hasta en el 8,4%[11].
Probablemente, la población cirrótica en espera de un TH sea la mejor estudiada en este sentido. Tres estudios[13]-[15] de cohortes amplias (465, 323 y 864 pacientes) de candidatos a TH sin CHC fueron evaluadas fundamentalmente en cuanto a los hallazgos intraoperatorios de TP, con prevalencias comunicadas muy uniformes: 9, 8,7 y 9,6%, respectivamente. No obstante, con parecidos requisitos diagnósticos, en una cohorte de 3295 pacientes evaluados para TH[16], no se confirmó la influencia del CHC, en dicho contexto, sobre la mayor prevalencia de TP: la proporción de trombosis fue sólo del 4,5%. Los criterios rigurosos de inclusión de pacientes con CHC en lista de TH tuvieron, evidentemente, influencia en este resultado.
Hay, por otra parte, numerosos estudios[17]-[21], diseñados con otros propósitos, que comunicaron de forma paralela datos de prevalencia de TP en pacientes cirróticos sin CHC tanto dentro como fuera del escenario del TH. Algunos de estos estudios comunicaron igualmente datos de incidencia. Zocco et al[20] y Amitrano et al[22] coincidieron plenamente al reportar una incidencia anual de 16% de TP en dos series cortas (73 y 61 pacientes, respectivamente) de cirróticos sin CHC evaluados exclusivamente mediante ecografía. En el estudio de Francoz et al[11], en cambio, la incidencia fue sustancialmente menor (7,4%), a pesar de incluir enfermos en lista de TH con o sin CHC; la explicación de este dato debe estar en el hecho de que se exigía confirmación de la TP mediante exploraciones radiológicas adicionales.
En conclusión, aunque con una amplia variabilidad, la prevalencia y la incidencia de la TP en la cirrosis hepática, sobre todo cuando está descompensada, son de aproximadamente un 10%. La frecuencia comunicada de TP en la cirrosis aumenta con el uso exclusivo de la ecografía y disminuye cuando se exige confirmación quirúrgica o radiológica adicional. La presencia del CHC influye de forma importante en presencia de TP pero no parece hacerlo dentro del contexto del TH, con los criterios de selección de candidatos habitualmente empleados. No obstante, no existe ninguna recomendación especial sobre la detección precoz de la TP en la cirrosis más allá de la derivada del despistaje de CHC.
¿Por qué y en quién se desarrolla la trombosis portal en la cirrosis?
Del manejo de la enfermedad tromboembólica venosa en otros territorios hemos ido aprendiendo los factores de riesgo involucrados en la patogenia de la trombosis, de acuerdo con la triada de Virchow: lesión endotelial, estadio trombofílico (predominantes en la TPNCNT) y trastorno hemodinámico local (predominante en la cirrosis).
No deja de ser una paradoja que en una situación clásicamente considerada como de riesgo hemorrágico (como la cirrosis), por déficit de síntesis proteica de factores de la coagulación, se postule que pueda existir una situación subyacente de hipercoagulabilidad[20], [23]. El estudio detallado de las alteraciones de la hemostasia, en sentido amplio, de los pacientes con cirrosis, sobrepasa el objetivo de esta revisión[24]. No obstante y de forma muy somera, comentaremos que en la cirrosis se han documentado trastornos funcionales[10,19], [25] que conllevarían un aumento del riesgo trombótico (déficits de anticoagulantes naturales de síntesis hepática -como las proteínas C y/o S o la antitrombina III- o exceso de otras proteínas procoagulantes -como el factor VIII-). Por otra parte, en la TP de los pacientes con cirrosis se ha comunicado igualmente una frecuencia mayor de la esperada de mutaciones (del factor V Leiden, del gen G20210 de la protrombina o del gen TT677 de la metilentetrahidrafolato reductasa) que confieren de forma inherente un aumento del riesgo trombótico[9], [21]. No obstante, no parece que estas situaciones de hipercoagulabilidad tengan un papel demasiado relevante en la mayor parte de los pacientes con cirrosis y TP[26]. Si esto no fuese así cabría esperar un marcado aumento de eventos tromboembólicos en otros territorios y, sin embargo, en la literatura la información al respecto es cuando menos contradictoria: en algunos estudios la prevalencia de trombosis venosa profunda y/o tromboembolismo pulmonar fue menor[27], en otros igual[28] y en otros mayor[29], [30] que en población hospitalizada equiparable y sin enfermedad hepática de base. El principal valor de la investigación exhaustiva de una situación trombofílica subyacente en la cirrosis en pacientes con TP es su capacidad de detectar a aquel pequeño grupo de enfermos en los que la anticoagulación será forzosamente necesaria de forma indefinida.
En estudios transversales se han identificado distintas situaciones[11], [21], [22], [32], [33] que producen directa o indirectamente daño endotelial, y que se han asociado estadísticamente con una mayor probabilidad de tener o desarrollar TP, también en el contexto de la enfermedad hepática crónica (Figura 1): especialmente la presencia de shunts portosistémicos o de cirugía abdominal previa (sobre todo esplenectomía).
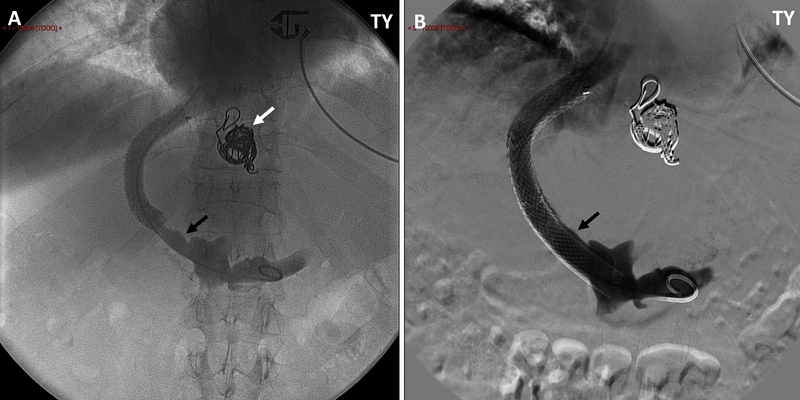
Figura 1
Esplenoportografía directa a través de derivación portosistémica intrahepática transyugular (A) que muestra defecto de replección por trombosis mural en la vena porta extrahepática (flecha negra) y material de embolización de varices gastroesofágicas (flecha blanca). El paciente había sido sometido dos meses antes a la derivación -con embolización simultánea- y en aquel momento presentaba totalmente permeable el eje esplenoportal, por lo que la asociación de la trombosis de novo con alguno de los anteriores procedimientos es inequívoca. Se colocó una prótesis Wallstent (B) cubriendo el trombo mural (flecha) resolviéndose así el problema. TY: transyugular.
Finalmente, el principal factor de riesgo que ha demostrado de forma prospectiva relacionarse de manera evidente y uniforme con el riesgo de TP en pacientes con cirrosis es la disminución del flujo en la vena porta por debajo de 15 cm/s[20], ya sea como consecuencia de la HTP o del tratamiento de ésta con betabloqueantes no selectivos (BBNS). Por lo demás, los mecanismos finales por los que algunos de estos pacientes con cirrosis desarrollan TP (y otros no) siguen siendo aún meramente especulativos.
Otras circunstancias que se han mostrado asociación estadística en algunos estudios (encefalopatía, ascitis o peritonitis bacteriana espontánea, plaquetopenia y enfermedad hepática en general avanzada) deben valorarse siempre desde la disyuntiva de la causa-consecuencia[34].
En conclusión, aunque con una participación simultánea de varios factores de distinta índole, el principal factor de riesgo para TP en la cirrosis es la reducción de la velocidad del flujo portal (por debajo de 15 cm/s) producido de forma espontánea o farmacológica. La detección de situaciones de trombofilia subyacente puede tener implicaciones terapeúticas (fundamentalmente relacionadas con la duración del tratamiento anticoagulante). El conocimiento de distintas situaciones o entidades asociadas a la TP en la cirrosis ayuda a identificar a un subgrupo de pacientes con un riesgo adicional.
¿Cómo diagnosticar y clasificar la trombosis portal en la cirrosis?
El descubrimiento incidental de una TP en cirróticos es un hecho frecuente en el contexto del despistaje rutinario de CHC y/o con el empleo cada vez más frecuente de estudios radiológicos con una magnífica fiabilidad diagnóstica para trastornos del eje esplenomesentéricoportal. En la enfermedad hepática crónica la trombosis suele afectar a la porta principal o a cualquiera de sus ramas pero cualquier componente de este eje se puede ver afectado, tanto de forma aislada como en combinación[35].
La ECO abdominal es la primera prueba a realizar; la permeabilidad de la vena porta se puede estudiar mejor con la adición de Doppler, constituyendo esta modalidad la de primera elección[36] como prueba índice. Los inconvenientes de la ECO-Doppler son su dependencia del operador[37] y su incapacidad, comúnmente, para explorar de forma completa todos y cada uno de los componentes del eje esplenoportal[38]. La angiografía por TC o por RM aporta información adicional sobre la extensión de la trombosis y sobre la enfermedad hepática subyacente e informa acerca de la existencia de factores locales promotores de la trombosis. El angio-TC[39] es la técnica que mejor define el eje vascular mientras que la RM[40] es la técnica preferida para valorar alteraciones biliares. El angio-TC aporta, además información sobre la posible cronicidad[41] y/o malignidad de la de la TP[42].
Estas exploraciones adicionales permiten asimismo tener un punto de partida que ayude a determinar la necesidad del tratamiento (y la respuesta a éste) y los problemas técnicos que pudieran surgir ante un eventual TH. De esta manera, se han establecido una serie de definiciones clásicas para la TP relacionada con una enfermedad hepática subyacente (Figura 2). En este sentido, la TP se considera aguda o subaguda cuando no estaba presente en el estudio de imagen semestral previo (despistaje de hepatocarcinoma) y cuando no muestra datos radiológicos de cronicidad: calcificaciones, colaterales -portoportales o portosistémicas- o cavernomatosis. Cuando presenta datos radiológicos de cronicidad o cuando era ya conocida del estudio de imagen semestral previo se considera crónica (pudiendo diferenciarse entre su forma estable o su forma con progresión en el tiempo). Al mismo tiempo, la recanalización o repermeabilización se considera completa cuando se consigue la permeabilidad del tronco principal de la vena porta y de al menos una de sus dos ramas así como de las venas esplénica y mesentérica superior; en cambio, se considera sólo parcial si el tamaño de la trombosis se reduce en al menos un 50% o cuando se consigue permeabilidad vascular pero sin llegar a cumplir los criterios de respuesta completa. Otras situaciones no contempladas en las definiciones previas deben considerarse como ausencia de respuesta. Es evidente, pues, que cualquier dato relacionado con la incidencia, prevalencia y pronóstico de la TP en la cirrosis, o con su tratamiento (o la respuesta a éste) puede verse artefactado por la minuciosidad con la que se realicen e interpreten las distintas pruebas de imagen.
¿Qué se conoce y qué se desconoce de la evolución natural y del pronóstico?
La verdadera capacidad de la TP para producir hemorragia varicosa o empeorar la función hepática[43] es aún objeto de debate. Se demostró, por ejemplo, en un estudio que la TP puede desaparecer espontáneamente hasta en un 45 % de los pacientes con cirrosis[44]. De hecho, el conocimiento de la historia natural de la TP en la cirrosis es aún deficiente y, en ocasiones, la asociación entre la descompensación hepática y la TP es confusa, sin poder dilucidarse cuál es la causa y cuál la consecuencia[34]. En la TP que acontece en el contexto de una cirrosis hepática[10] no suele haber clínica de dolor abdominal (18%) y aún menos infarto intestinal, al contrario de lo que suele suceder en la TP aguda no cirrótica. Suele tratarse, pues, de un hallazgo incidental ecográfico detectado en pacientes estables (43%) o en el contexto de una descompensación, fundamentalmente hemorragia varicosa o relacionada con HTP (39%). Incluso en esta situación -tan ampliamente estudiada-, la trombosis se ha relacionado con fracaso del tratamiento inicial[45] pero no con el resangrado o la mortalidad en las primeras 6 semanas[46]. En cambio, en otros estudios se describió que la existencia de una TP era un predictor independiente de mortalidad en pacientes con cirrosis en el momento de su evaluación e inclusión para un TH[16].
Sí es algo mejor conocido el efecto deletéreo de la TP sobre la morbilidad y mortalidad de los candidatos a TH, sobre todo si la vena mesentérica superior se ve involucrada[32], [33]. Precisamente es en el contexto del TH donde la historia natural de esta entidad ha sido más evaluada, habiéndose relacionado en algunos estudios retrospectivos (pero no en otros) la existencia de una TP completa[11], [14] con un aumento de la mortalidad con respecto a la de los pacientes sin TP (o con TP parcial). Para ambas circunstancias (TP parcial o completa) se ha comunicado mayor morbilidad[13], [15]-disfunción primaria del injerto, insuficiencia renal y retrombosis-, aunque la asociación es dudosa e interpretable puesto que la etiología de dichas complicaciones suele ser multifactorial. En consecuencia, el impacto de la TP sobre el TH y las complicaciones posteriores no está aún definido de forma exacta. Una vez más aparece el sesgo de selección propio de los pacientes que no fueron evaluados para TH por tener una TP extensa; los datos contradictorios sobre la mortalidad pueden relacionarse asimismo con el hecho de no haber identificado bien a los pacientes con TP parcial o completa y con el diseño retrospectivo de los estudios. Afortunadamente, gracias a los avances técnicos y los mejores cuidados perioperatorios, en la actualidad, la TP sólo se considera una contraindicación relativa para el TH[47].
¿Cuál es el mejor manejo de estos pacientes?
Para contestar a esta pregunta deberíamos centrarnos anteriormente en las siguientes premisas:
1) En cualquier situación el diagnóstico precoz es básico; se debe investigar la permeabilidad portal en los estudios semestrales ecográficos con lo que se podría reducir (pero no evitar) los casos de cavernoma.
2) Las evidencias disponibles con respecto al tratamiento están basadas en series de casos y la principal duda que se plantea en la práctica clínica es su aplicabilidad.
3) Los objetivos del tratamiento son conseguir la repermeabilización vascular o, al menos, evitar la progresión de la TP, en cantidad suficiente como para permitir el TH, en el caso de que sea necesario.
4) El tratamiento debe individualizarse: a veces es innecesario[14], [44], no es siempre posible y en muchas ocasiones puede ser muy perjudicial.
Anticoagulación
El primer estudio que evaluó la eficacia y seguridad de la anticoagulación en pacientes con cirrosis hepática y TP data del año 2005[11]; en dicho estudio se trataron con heparina de bajo peso molecular (HBPM) seguida de anticoagulantes orales (ACO) 19 de un total de 251 pacientes; las tasas de respuesta completa y parcial fueron del 42 y 5%, respectivamente. En 2010, Amitrano et al.[48] trataron exclusivamente con HBPM a 28 de 39 pacientes con TP y cirrosis, con unas tasas de repermeabilización completa y parcial del 75 y 8%, respectivamente. Ese mismo año, Senzolo et al.[49] comunicaron en cambio tasas de respuesta completa sustancialmente menores (36%) en 33 de 56 pacientes de similares características y tratados igualmente con HBPM. En ninguno de estos tres estudios se produjo mortalidad asociada al uso de anticoagulación y las complicaciones reportadas fueron menores y extraordinariamente poco frecuentes. En un estudio español, en cambio, publicado en 2011[50], sobre 55 pacientes en los que se usó tanto HBPM como ACO, la tasa de respuesta completa fue del 45% y la de respuesta parcial del 15%, sin mortalidad asociada, pero con hasta 11 episodios hemorrágicos durante el tratamiento (6 de ellos condicionados por hemorragia por varices).
Una vez expuestos los datos globales de estos estudios hay varios asuntos que merecen una atención especial. En primer lugar, la tasa de respuesta completa, tan variable, tuvo que ver en parte con el tipo de trombosis que existiera basalmente pero también con el tiempo de tratamiento, siendo sustancialmente mayor cuando se alargaba éste hasta los 12 meses[48]. Por otra parte, la instauración precoz del tratamiento se asoció a una mayor tasa de respuesta[50] mientras que la discontinuación del mismo se asoció a retrombosis en aproximadamente un tercio de los casos (27 y 38,5%, respectivamente) en los dos estudios en los que se evaluó este aspecto[48], [50]. La conclusión inicial que se puede extraer, pues, es que la anticoagulación ha de plantearse en estos casos como un tratamiento a largo plazo (o hasta el TH) con el inconveniente de que las "incómodas" HBPM aparentaron ser no sólo más seguras sino también más eficaces que los antagonistas de la vitamina K. Aparte de la duración del tratamiento, estamos aún muy lejos de poder recomendar un tipo concreto de HBPM, una dosis óptima y una manera adecuada de monitorizar la terapia[51]. En el estudio de Francoz et al.[11] se empleó nadroparina 5700 UI sc diarias mientras que en el de Amitrano et al.[48] enoxaparina 200 UI/Kg sc diarias. Todas estas dudas han generado múltiples comentarios y editoriales[52], [53] en la literatura médica en tanto en cuanto que las recomendaciones generales al respecto del uso de anticoagulantes en la TP de la cirrosis se han basado casi exclusivamente en recomendaciones de expertos[31].
Por otra parte, hay que considerar finalmente la mejor profilaxis de hemorragia (varicosa) y de otro tipo en este grupo de pacientes. El factor que se relacionó de forma estadísticamente significativa (p 0,018) con el riesgo de eventos hemorrágicos en el estudio de Delgado et al.[50] fue una cifra de plaquetas inferior a 50x109/L. De hecho, las fichas técnicas de las distintas modalidades de HBPM suelen contraindicar su empleo por debajo precisamente de esta cifra[51]. En ausencia de recomendaciones específicas, casi todos los autores recomiendan ceñirse de forma lo más rigurosa posible a las normas generales establecidas en las guías de práctica clínica[54] pero considerando siempre la contrapartida de que tanto los BBNS como las distintas modalidades de tratamiento endoscópico se han involucrado -por distintos mecanismos- en la génesis de la TP en cirróticos. En el estudio de Amitrano et al.[48], la modalidad de tratamiento endoscópico usada en los pacientes con hemorragia varicosa aguda y TP fue la ligadura, postponiendo, hasta conseguir la erradicación variceal, el tratamiento anticoagulante, lo que supuso un retraso medio de unos 4 meses. Si esta estrategia secuencial es la más apropiada sigue siendo objeto de debate[31] en vistas de la seguridad que aparenta tener la ligadura endoscópica en pacientes bajo tratamiento con HBPM, dado que la eficacia en la repermeabilización puede verse comprometida por el retraso en el inicio del tratamiento. En cualquier caso, parece sensato obtener la erradicación variceal tan pronto como sea posible. Finalmente, partiendo de la base del impacto negativo de la TP sobre la HTP de los pacientes cirróticos, se ha postulado que la repermeabilización obtenida mediante anticoagulación podría mejorar en sí mismo las manifestaciones clínicas de la HTP, de forma que ésta sería la mejor profilaxis posible. De hecho, la anticoagulación, a pesar su pobre aplicabilidad y de los demás inconvenientes previamente comentados, sigue constituyendo el tratamiento de primera línea de los pacientes con cirrosis y TP[31].
TIPS
La modificación de la hemodinámica local que se consigue en el sistema venoso portal con la colocación de derivaciones portosistémicas por vía transyugular (TIPS) hace esta modalidad de tratamiento muy atractiva en el tratamiento de la TP en la cirrosis. En teoría, todos los inconvenientes, contraindicaciones y riesgos de la anticoagulación podrían eliminarse. No obstante, se trata de intervenciones complejas y laboriosas desde el punto de vista técnico (Figuras 3 y 4), en donde el porcentaje de complicaciones relacionadas con el procedimiento no es despreciable. Una vez más el principal problema que surge en este caso es el de la aplicabilidad; de hecho, clásicamente la TP se ha considerado una contraindicación para la inserción de un TIPS. En la práctica clínica, no obstante, varios estudios han mostrado que la colocación del TIPS es posible con una elevada tasa de éxito[55]-[59] cuando se cumplen una serie de requisitos mínimos, que son ya conocidos desde el primer estudio al respecto, publicado en 2006[55]: presencia de una rama portal patente y ausencia de cavernomatosis portal. En este estudio se incluyeron no sólo 13 pacientes cirróticos (donde la tasa de éxito fue del 76,9%) sino también 15 pacientes con TPNCNT. Las tasas de repermeabilización sólo se comunicaron en un estudio [56]: completa en el 57% y parcial en el 30%; la mayor extensión de la trombosis, su carácter crónico y la presencia de varices esofágicas son factores que se relacionaron negativamente con el éxito en la repermeabilización. Estos hallazgos fueron más o menos similares a los observados previamente por Perarnau et al[57]: su tasa de éxito fue del 79% en pacientes con TP completa (34 de los 128 pacientes de su serie) y del 99% en pacientes con TP parcial (94/128). En ocasiones, en estos estudios, se usaba tratamiento anticoagulante previo y/o posterior al TIPS buscando una mayor tasa de éxito técnico o bien la consolidación de la repermeabilización vascular obtenida.
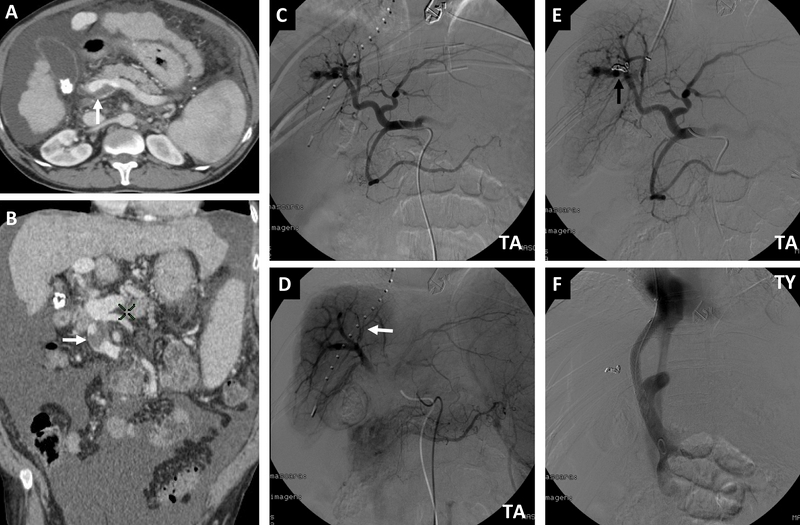
Figura 3
TC abdominal (A y B) que muestra trombosis portal extrahepática parcial (flechas). Arteriografía hepática (C, D y E) que permite ver vascularización portal en fase temprana (flecha blanca) secundaria a la existencia de fístula arterioportal que se trató posteriormente mediante coils (flecha negra). Finalmente se se colocó un stent cubierto con buen resultado morfológico y funcional (F). TA: transarterial; TY: transyugular.
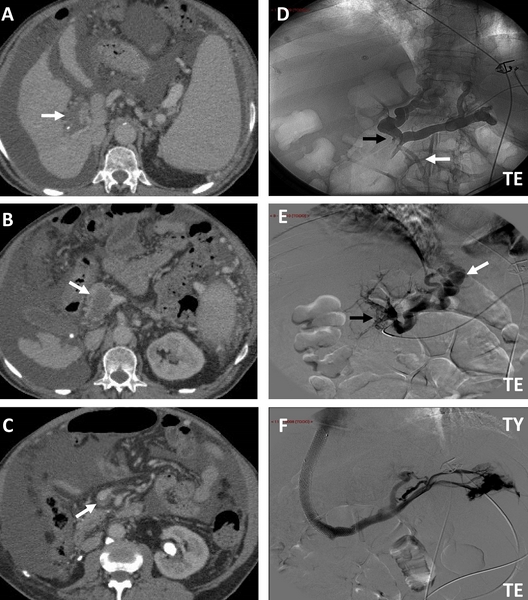
Figura 4
TC abdominal que muestra defecto de replección (flecha) por trombosis completa de la vena porta intra y extrahepática (A) que se extiende hasta la vena mesentérica superior (B y C), siendo parcial a este nivel (flechas). Flebografía transesplénica (D) que muestra trombosis parcial de la vena mesentérica superior (flecha negra) y permeabilidad de la vena mesentérica inferior (flecha blanca). Se repermeabilizó la trombosis portal por vía transesplénica (E) visualizándose múltiples defectos de replección (flecha negra) y varices esofágicas (flecha blanca). Derivación portosistémica intrahepática transyugular (F) con stent cubierto y prolongación mediante prótesis Wallstent con ausencia posterior de relleno de las varices. TE: transesplénica; TY: transyugular.
Otra limitación de estos estudios es la relacionada con su diseño retrospectivo, que impide conocer exactamente cuántos pacientes ni siquiera fueron considerados para la colocación de un TIPS por no cumplir los requisitos mínimos en la evaluación radiológica previa. Por otra parte, la indicación del TIPS en estas series no fue casi nunca la TP en sí misma sino una situación global de HTP severa, en la que, además, existía una TP. Tan sólo 2 pacientes del estudio de Senzolo et al.[55]. y 4 del de Luca et al.[56] fueron sometidos al TIPS exclusivamente por su TP.
Los resultados con respecto al éxito en la inserción, al número de pacientes incluidos y a la mortalidad relacionada con el procedimiento de los principales estudios disponibles -desgraciadamente series cortas- en la literatura médica se muestran en la tabla 1.