CORRESPONDENCIA
Juan Jesús Puente Gutiérrez
Hospital Alto Guadalquivir
Avda. Blas Infante, s/n.
23740 Andújar (Jaén)
Introducción
La distensión abdominal (DA) es una alteración clínica consistente en la sensación de hinchazón abdominal, acompañada o no de un aumento objetivo en el perímetro abdominal. Se trata de un trastorno muy frecuente en la población general donde los estudios epidemiológicos han descrito una prevalencia entre 17-21%[1], cifra que puede alcanzar el 90% en el grupo de pacientes con trastornos funcionales digestivos[1],[2], representando además uno de los síntomas más molestos que refieren estos pacientes[2]. Por tanto, la DA supone un motivo de consulta muy frecuente tanto en Atención Primaria como en las consultas de Gastroenterología. A pesar de su importancia clínica, no se conocen bien los mecanismos fisiopatológicos responsables de la DA y, en consecuencia, tampoco existe un tratamiento específico, lo que plantea numerosos retos a la hora de su abordaje tanto por parte del clínico como por parte del paciente (Tabla 1).
Tabla 1
Retos que plantea par el clínico y el paciente la DA.
En este artículo vamos a revisar los conocimientos actuales sobre los mecanismos implicados en la fisiopatología de la DA, aportamos algunas pautas de actuación orientadas a diagnosticar correctamente a estos pacientes y revisaremos las opciones terapéuticas disponibles conforme a dichos conocimientos fisiopatológicos y a las evidencias disponibles en los ensayos clínicos.
Definición
Podemos definir la DA como una sensación de hinchazón o presión abdominal o sensación de gas atrapado, con o sin aumento del perímetro abdominal. Esta definición se complica y convierte en confusa ya que engloba a dos grupos de pacientes, mejor diferenciados con la terminología utilizada en inglés que en castellano: de un lado, aquellos con sensación de distensión acompañada de un incremento del perímetro abdominal objetivo y medible (lo que representa un signo clínico en la exploración física), definido en inglés como "distension" y, de otro lado, aquellos sujetos con sensación de distensión sin que se objetive un aumento del perímetro abdominal, definido en inglés con el término "bloating". De hecho, en solo la mitad de los pacientes que se quejan de DA se logra demostrar DA objetiva[3],[4].
A la confusión en la definición se añade la confusión derivada de su encaje dentro de la clasificación de los trastornos funcionales digestivos, dado que la DA no deja de ser un síntoma inespecífico que puede observarse en pacientes con distintos trastornos. Así, los trastornos funcionales intestinales se clasifican según los criterios de Roma IV en síndrome de intestino irritable (SII), estreñimiento funcional, diarrea funcional, distensión funcional y trastorno funcional no especificado[5]. En ese contexto, los pacientes con DA están dispersos entre las distintas categorías, mezclados a su vez con pacientes sin distensión, y sólo aquellos que no reúnen los criterios diagnósticos de estas entidades, se categorizan (por exclusión) como DA funcional (Tabla 2).
Tabla 2
Criterios diagnósticos de DA funcional conforme a la clasificación Roma IV de trastornos funcionales digestivos.
[i] Lista de abreviaturas. DA: distensión abdominal. SII: síndrome de intestino irritable. † Los síntomas deben haberse iniciado por lo menos 6 meses antes del diagnóstico y deben estar presentes durante los últimos 3 meses. Tomado de Lacy et al.[5].
Epidemiología
Estudios poblacionales estiman una prevalencia de la DA entre 17-21%. Esta aumenta de forma notable si nos centramos en aquellos pacientes con enfermedades funcionales digestivas, pues entre 60-88% de los pacientes con SII refieren DA como síntoma predominante, llegando a ser catalogado como el síntoma más molesto, por encima del dolor abdominal[1]-[4]. También es más frecuente en mujeres con una ratio de 2:1[6]. Aunque está presente en todos los subtipos de SII, su prevalencia varía de 80% en SII con predominio de estreñimiento (SII-E) a 40% en SII con predominio de diarrea, existiendo en el primer caso correlación entre el síntoma y la DA objetiva[7].
Presentación clínica
La DA suele fluctuar en su intensidad a lo largo del día, empeora conforme este avanza, y luego mejora durante la noche[8]. Característicamente también empeora tras la ingesta, habiéndose descrito que la comida rica en fibra, lácteos o grasas la favorece[9]-[11]. No obstante, en ocasiones no importa lo que se haya comido y la ingesta de pequeñas cantidades de alimento o agua pueden llegar a desencadenarla. También se ha descrito que la DA puede empeorar con el estrés y mejorar tras la relajación. Además, los pacientes suelen referir un empeoramiento durante el período menstrual, si bien no se han visto diferencias entre mujeres pre y postmenopáusicas, ni entre fases del ciclo menstrual[12]. Finalmente recalcar que, dado que es un síntoma presente el contexto de numerosos trastornos funcionales digestivos, es lógico que este se asocie con otros síntomas acompañantes definitorios de dicho trastorno, como estreñimiento, diarrea, dolor abdominal, etc.
Medición
La medición de la DA también representa un reto tanto en la clínica diaria como en la investigación. Así, en aproximadamente la mitad de los casos sólo existe sensación de hinchazón sin distensión objetiva, lo cual es difícil de cuantificar, utilizándose escalas numéricas subjetivas, variables de unos estudios a otros. En el caso del aumento objetivo del perímetro abdominal, existe la dificultad añadida de ser un fenómeno variable y oscilante a lo largo del día en cada individuo. Para su medición, existen diferentes métodos experimentales. El más sencillo es la utilización de una cinta métrica adherida a un cinturón, que ha demostrado ser capaz de medir cambios en el perímetro abdominal tras la infusión de gas en el intestino de sujetos sanos[13]-[15]. Otra técnica más precisa es la pletismografía de inductancia[16], basada en la propiedad de los circuitos eléctricos por la cual la resistencia de una bobina varía según sus características físicas y longitud. Este aparato está formado por una banda de tela elástica con un cable espiral que, al expandirse, modifica su geometría resultando en un cambio en el valor de la inductancia. Mediante esta técnica, se han demostrado variaciones objetivas en el perímetro abdominal a lo largo del día, significativamente mayores en pacientes con SII y DA que en sujetos sanos, alcanzando incrementos de hasta 12 cm[3]. Otros estudios han medido la DA mediante tomografía computarizada (TC), lo que, además, permite cuantificar el gas intestinal en distintas localizaciones del intestino[17].
Fisiopatología
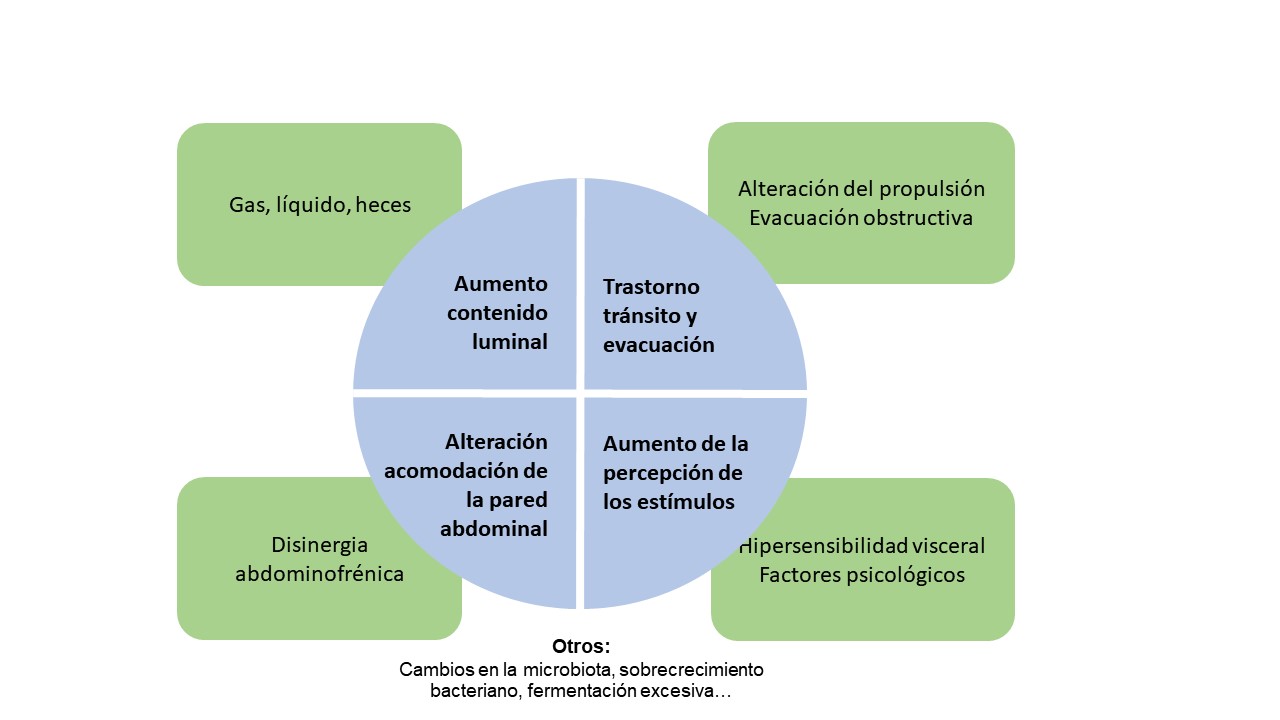
No se conoce un solo mecanismo fisiopatológico, pudiendo más bien estar implicados una combinación de mecanismos cuyo peso puede variar de un individuo a otro. Los más importantes que se han postulado son[18] (Figura 1):
Figura 1
Esquema-resumen de la fisiopatología de la DA (distensión abdominal). Adaptado de Iovino et al.[18].
1. Incremento del contenido luminal intestinal (gas, heces, líquido).
2. Trastorno del vaciamiento abdominal (propulsión y evacuación del contenido intestinal).
3. Alteración en la percepción de los estímulos intestinales (hipersensibilidad visceral, factores psicológicos, etc.).
4.Alteración en la adaptación al volumen intraabdominal (disinergia abdominofrénica).
5. Otros: alteraciones en la microbiota, sobrecrecimiento bacteriano, fermentación excesiva de los alimentos, etc.
Vamos a dedicar a continuación un breve apartado a aclarar conceptos sobre fisiología del gas intestinal, dado que va a ser muy necesario para poder comprender la fisiopatología de la DA.
1. Fisiología del gas intestinal.
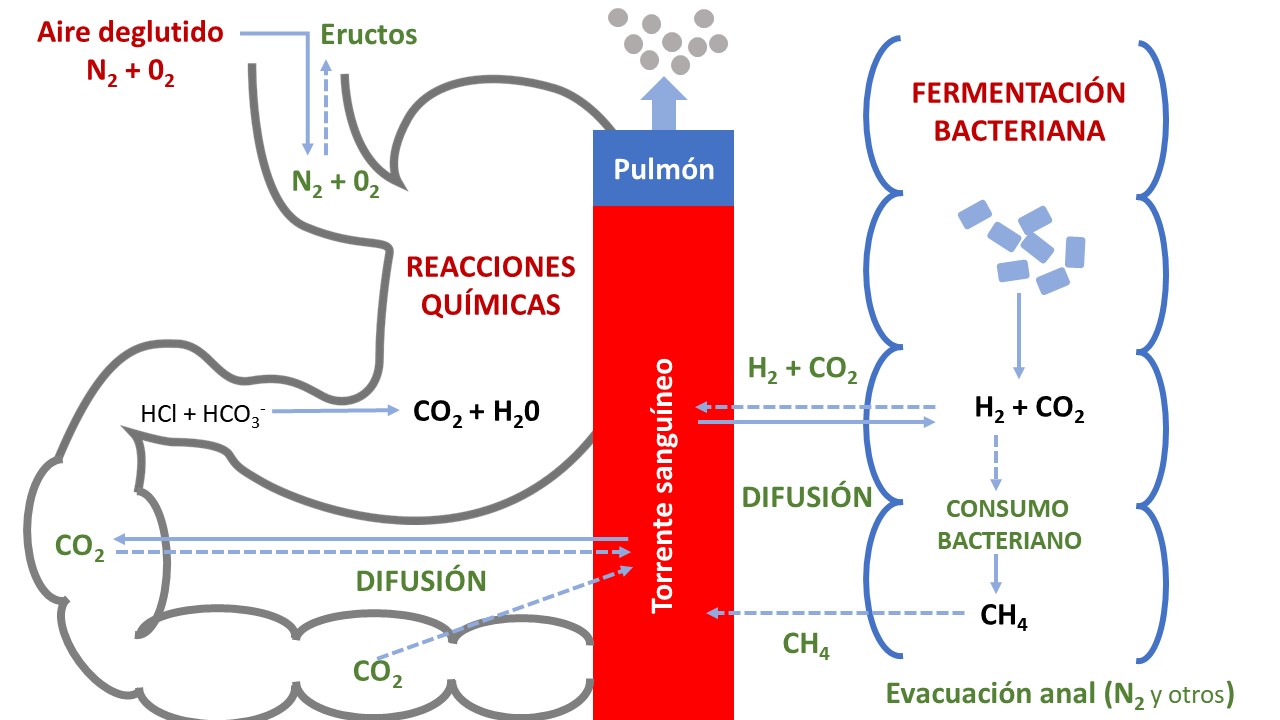
El gas intestinal ha sido el elemento responsable de la DA más estudiado y con un papel central en la fisiopatología de la DA, por encima de otros elementos del contenido abdominal. Su volumen y composición han sido estudiados desde hace muchos años, utilizando la técnica de lavado, consistente en la infusión de argón en el intestino a un ritmo alto (40 ml/min) a la vez que se recupera el gas rectal[19],[20]. Así se ha demostrado que, a pesar de la gran capacidad del tubo digestivo, el volumen de gas existente en la luz intestinal es muy pequeño, entre 100-300 ml, y está compuesto fundamentalmente por cinco gases: nitrógeno (N2), oxígeno (O2), dióxido de carbono (CO2), hidrógeno (H2) y metano (CH4), además de pequeñas proporciones gases sulfurosos, responsables del mal olor. La existencia de un volumen de gas intestinal tan pequeño y relativamente constante contrasta con las grandes cantidades de gas que diariamente entran y se producen en el intestino, lo que implica la existencia de un estrecho balance entre su formación y su eliminación (Figura 2). Así, la entrada o producción de gas intestinal viene determinada por[21],[22]:
1) La ingesta, que introduce unos 15 ml de aire por cada deglución, calculándose que diariamente se pueden ingerir varios litros de gas.
2) Las reacciones químicas producidas en el intestino delgado proximal por la neutralización del ácido gástrico con el bicarbonato duodenal, dando lugar a la liberación de gran cantidad de CO2 y agua.
3) La difusión desde el torrente sanguíneo. Esta viene determinada por el gradiente de presión, el coeficiente de difusión de cada gas y el tiempo de exposición (velocidad de tránsito intestinal). Los tres gases que pueden difundir entre la sangre y el tubo digestivo son N2, O2 y CO2. De ellos, tanto O2 como CO2 tienen una gran difusibilidad, por lo que difunden rápidamente para equilibrar sus presiones parciales.
4) La fermentación bacteriana en el colon de los polisacáridos ingeridos en la dieta que no han sido absorbidos en el intestino delgado, dando lugar a la liberación de H2, CH4 y CO2, en proporciones variables según la composición de la dieta y la flora colónica de cada individuo.
Por su parte, la eliminación o salida del gas intestinal se realiza por otros cuatro mecanismos[21],[22]:
1) Los eructos.
2) La difusión desde el tubo digestivo (los principales gases así eliminados son H2, CO2 y CH4). En el caso del H2, más de dos tercios de su producción difunden a la sangre y son posteriormente exhalados, constituyendo el principio básico de los test de aliento.
3) El consumo bacteriano (por ejemplo, bacterias que consumen gran cantidad de H2 y liberan CH4, hasta en el 30% de la población).
4) La evacuación a través del ano del exceso de gas no eliminado por los mecanismos anteriores (principalmente N2 y gases sulfurosos).
2. Volumen o contenido de gas en la DA.
Distintos estudios han observado la cantidad y composición del gas en los pacientes con SII y DA[17],[23]-[25] utilizando diversas técnicas y han concluido que el contenido de gas es mayor que en sujetos sanos (entre un 28-54%), si bien las diferencias en valor absoluto son pequeñas y, por tanto, de dudoso valor fisiopatológico, como en el trabajo de Serra et al.[24] (199 vs. 287 ml), que comparó las diferencias de gas endógeno en 20 sujetos sanos y otros 20 con SII y DA, mediante el test de lavado. Tampoco se ha podido encontrar correlación entre volumen de gas y distensión (objetiva o subjetiva)[26],[27]. Otros trabajos, como el de Accarino et al.[28] estudiaron estas diferencias justo durante los episodios de distensión, momento en que también se detectó un aumento significativo de la cantidad de gas en las imágenes obtenidas mediante TC, si bien, al igual que en los estudios anteriores realizados en condiciones basales, este era relativamente pequeño. Incluso otro estudio en pacientes con SII y DA encontró que, aunque el perímetro abdominal aumentaba durante el día, no se detectaban cambios significativos en la cantidad de gas intra-abdominal[15].
Por tanto, aunque los pacientes con DA suelen tener la sensación de que la causa de las molestias es un exceso de gas intestinal, diferentes estudios no han sido capaces de demostrar que estos pacientes tengan un incremento en el volumen de gas intestinal que justifique por sí solo la DA, orientando como principal problema fisiopatológico más bien un trastorno en el manejo del gas, es decir, una alteración en el tránsito y/o distribución y/o tolerancia a una cantidad de gas que puede ser normal o, como mucho, discretamente aumentada[17].
3. Alteración en el tránsito y evacuación del gas en la DA.
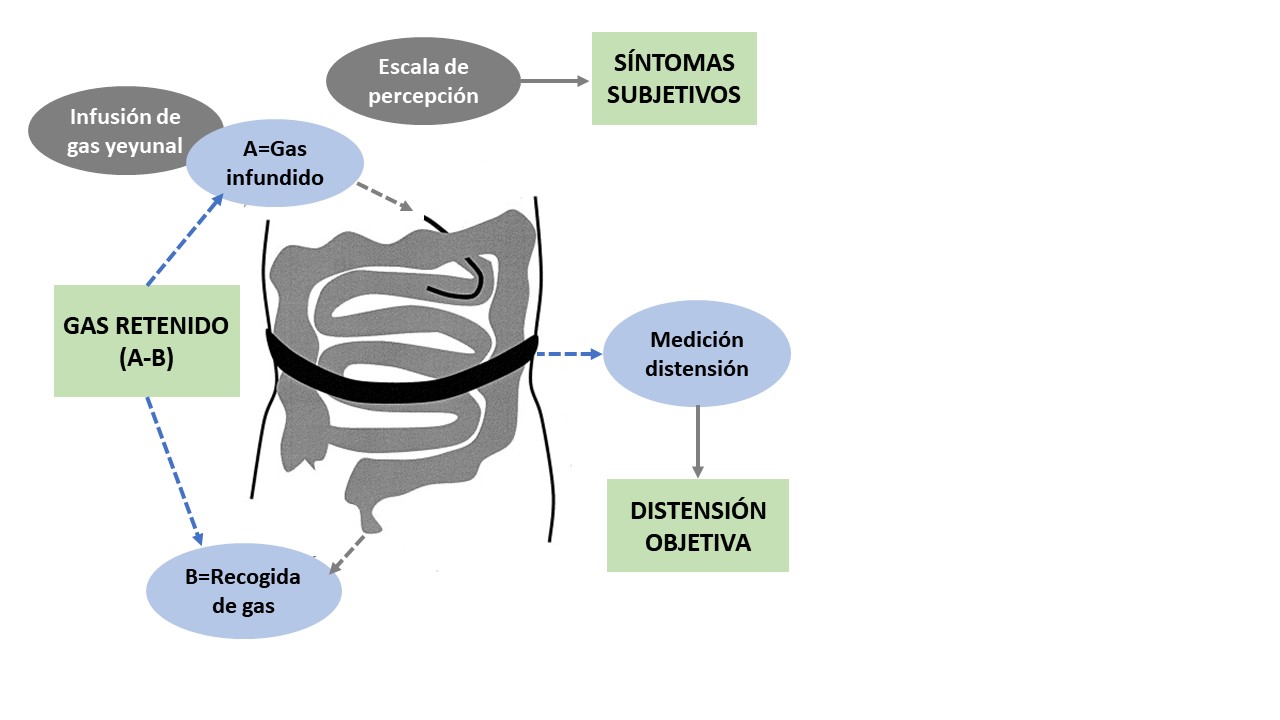
El tránsito y la tolerancia al gas se han evaluado experimentalmente mediante un test consistente en la infusión de una mezcla de gases (con iguales proporciones que en sangre venosa para evitar la difusión) a ritmo constante en el yeyuno proximal, mientras se cuantifica la evacuación de gas mediante una cánula rectal; paralelamente la DA se mide mediante una puntuación de percepción y/o mediante métodos objetivos (cinta métrica, pletismografía, etc.)[29] (Figura 3). En un estudio en 46 sujetos sanos, se comprobó que la mayoría (92%) eran capaces de propulsar y evacuar todo el gas que se les infundía a lo largo de tres horas independientemente de la velocidad de infusión (desde 1 hasta 30 ml/min) sin retener gas ni desarrollar síntomas[13]. Se deduce, por tanto, que nuestro intestino tiene un mecanismo regulador muy eficaz, capaz de eliminar cualquier exceso de gas de manera que un eventual aumento en el volumen de gas intestinal no tendría por qué conducir necesariamente a DA. Sin embargo, se ha demostrado que los pacientes con trastornos funcionales intestinales presentan una alteración del tránsito de gas que favorece su retención y se asocia con los síntomas abdominales. En un estudio mediante infusión de gas en el yeyuno, 18 de 20 pacientes con SII presentaban una evacuación de gas significativamente más lenta, reteniendo mayor cantidad de gas, en contraste con sólo 4 de 20 sujetos sanos[24]. Además, la infusión de gas reprodujo los síntomas habituales de estos pacientes, a la vez que desarrollaron DA objetiva, demostrándose además una correlación entre el volumen de gas retenido y el incremento del volumen abdominal. Estos hallazgos han sido corroborados en estudios posteriores, que obtuvieron resultados similares[25],[30]-[32].
Figura 3
Test experimental para valorar el tránsito, evacuación, retención del gas y su efecto sobre la DA (distensión abdominal). Adaptado de Harder et al.[29].
El mecanismo por el cual estos pacientes presentan retención de gas intestinal no queda bien aclarado. Experimentalmente, dos mecanismos pueden ser responsables de la retención de gas[33]: a) una alteración en la propulsión y b) un aumento de la resistencia al flujo.
Así, se sabe que la distensión del intestino en sujetos sanos produce una respuesta refleja de aceleración del tránsito que previene la acumulación de gas, en cambio, los pacientes con DA presentan una respuesta refleja anómala que no logra prevenir la retención de gas[34]. A su vez, estos cambios pueden modularse por la presencia de distintos agentes con efecto sobre la motilidad intestinal. Así, la infusión simultánea de lípidos (que inducen enlentecimiento de la motilidad) en el duodeno durante el test de infusión de gas, provoca aún mayor retención de gas y más síntomas[14],[35] y, al revés, la estimulación farmacológica con neostigmina durante el test de infusión provoca un aumento del aclaramiento del gas intestinal, una mejoría de los síntomas y de la DA objetiva[25],[36]. De manera paralela, otros estudios que han evaluado la velocidad del tránsito orocecal y colónico han encontrado que, en pacientes con SII-E que presentaban DA, estos eran significativamente más lentos que en aquellos sin DA y, a su vez, aquellos con tránsito más lento tenían más DA[37]. Además, estas alteraciones pueden tener mayor o menor relevancia en función del área intestinal afecta. Así, aunque se ha visto mediante TC que la distribución de gas es similar en sujetos sanos y sujetos con DA[17], se ha podido comprobar que la infusión yeyunal de gas induce mayor retención que la ileal o la colónica, lo que sugiere un papel más relevante del intestino delgado frente al colon como responsable de la DA[31],[35].
Por otra parte, también puede estar implicada una mayor resistencia al flujo intestinal[37]. Se ha visto que la retención de heces en el recto puede causar retraso en la motilidad intestinal a la vez que se ha implicado la disfunción anorrectal como un factor contribuyente en el desarrollo de DA. Así, en un estudio en 88 pacientes con SII se vió que quienes presentaban DA tenían un mayor tiempo de expulsión del balón rectal y mayores presiones del esfínter anal, incluso proponiendo el tiempo de expulsión del balón prolongado como predictor de DA[38].
4. Hipersensibilidad visceral en la DA.
Los pacientes con trastornos funcionales gastrointestinales muestran de forma característica una percepción anormal de los estímulos viscerales de manera que estímulos que pasan desapercibidos para los sujetos sanos, como pueden ser la retención de pequeñas cantidades gas o el tránsito anómalo de este, son percibidos como síntomas[18]. Las causas de esta hipersensibilidad visceral no están claras si bien parecen estar implicados factores genéticos, neuroendocrinos, fenómenos de aumento de la permeabilidad intestinal, alteraciones en la modulación del sistema nervioso simpático, alteraciones en el procesamiento de las señales por el sistema nervioso central, hiperatención-hipervigilancia, etc.[39].
Varios estudios han puesto de manifiesto este fenómeno en los pacientes con SII y DA[25],[28],[36]. Por ejemplo, un estudio comparó la respuesta a la infusión de gas en 15 sujetos sanos, 15 sujetos con SII y 15 pacientes con dismotilidad grave, encontrando que, a pesar de que los pacientes con dismotilidad grave retenían más gas que aquellos con SII, eran estos últimos los que presentaban una mayor sensación de distensión[36]. Paralelamente, también se ha podido comprobar que la percepción de los síntomas era mayor si la retención de gas era secundaria a un aumento de la resistencia al flujo (modelo obstructivo) que en el caso de una propulsión alterada[40]. Asimismo, se ha visto que la tolerancia a la retención de gas depende del segmento intestinal donde este esté principalmente acumulado; por ejemplo, en un modelo de retención por obstrucción del flujo en 40 sujetos sanos, la infusión de gas yeyunal dio lugar a más síntomas que la infusión rectal, a pesar de producir la misma DA[41].
5. Disinergia abdominofrénica.
Hemos visto cómo, mediante estudios de imagen, el discreto aumento en el contenido abdominal observado durante los episodios de DA no parecía justificar el aumento del perímetro abdominal observado en estos pacientes[17],[23]-[28]. Así, Accarino et al.[28] en un estudio en 56 pacientes con SII y DA a los que realizaban análisis morfovolumétrico mediante TC, vieron que, durante los episodios de DA, el gas intraluminal apenas se incrementó (32±12 ml) en tanto sí se apreciaba un aumento objetivo del diámetro anteroposterior abdominal (14±2 mm), comparado con la situación basal, antes del episodio de DA.
Esto podría explicarse por una alteración en los mecanismos de acomodación de la pared abdominal, gracias a la cual la pared abdominal se adapta a las variaciones fisiológicas del volumen intraabdominal (la ingesta, el llenado/vaciamiento vesical, la defecación, etc.) mediante cambios en la contracción de los músculos de la pared anterior del abdomen y el diafragma, evitando que se pueda producir una distensión del abdomen[26]. En un estudio en 12 pacientes con DA y 12 sujetos sanos, se evaluó mediante electromiografía la actividad de los músculos abdominales recto superior, recto inferior, oblicuo externo y oblicuo interno mientras se infundía gas durante un periodo de una hora. Se observó que la sobrecarga de gas produjo un aumento de la actividad muscular en sujetos sanos mientras que los pacientes con DA mostraban una falta de respuesta contráctil de los músculos rectos y oblicuo externo a la vez que se relajaba el músculo oblicuo interno[42]. Complementariamente, otros estudios mediante TC han objetivado que los pacientes con SII y DA presentaban un descenso significativo del diafragma asociado a la protrusión de la pared anterior abdominal durante los episodios de distensión[28]. En otro estudio posterior del mismo grupo investigador, utilizando el mismo modelo de infusión de gas y registro electromiográfico, se comprobó que, durante los episodios de distensión, se producía una relajación diafragmática en sujetos sanos (lo que daba lugar a un ascenso del diafragma, como adaptación al exceso de gas) mientras que los pacientes con SII y DA respondían al exceso de gas con una contracción del diafragma que, al descender, desplazaba el contenido abdominal y favorecía la DA junto con la relajación de la pared anterior abdominal[32]. Estos hallazgos se reprodujeron además en otros estudios que utilizaron test de provocación con comida[15].
Por lo tanto, los pacientes con DA presentaron una respuesta anormal de acomodación de la musculatura de la pared abdominal (en respuesta a pequeños cambios en el volumen intraabdominal), con contracción del diafragma y relajación del músculo oblicuo interno, denominada disinergia abdominofrénica[18],[32],[33].
6. Fermentación bacteriana en la DA.
La fuente principalmente estudiada de producción de gas en los trastornos funcionales es la fermentación bacteriana. Generalmente se trata de H2, CO2 (y CH4 en el 30% de la población, portadora de flora metanogénica). La producción de gas en la fermentación bacteriana depende fundamentalmente de la cantidad de residuos fermentables de la dieta no absorbidos en el intestino delgado que llegan al colon y de la composición de la flora colónica[21],[22],[43]. Así, una dieta rica en fibra o hidratos de carbono no absorbibles como el sorbitol o los fructanos incrementa la producción de gas y puede contribuir al desarrollo de síntomas de DA.
7. Papel de la microbiota en la DA.
El cuerpo humano está habitado por una comunidad de microorganismos vivos denominados microbiota. Se estima que está compuesta por unas 1.014 células, diez veces más que el total de las células humanas, la mayoría en el colon, predominando Firmicutes, Bacteroidetes y Actinobacteria[44].
Cada vez existen más evidencias que apoyan el papel de la microbiota en la patogenia del SII, a través de diferentes mecanismos (inflamación mucosa de bajo grado, aumento de la permeabilidad mucosa, activación de vías sensoriales nociceptivas, disregulación del sistema nervioso entérico, interacción con el sistema nervioso central, etc.)[45]. Además, como se ha comentado, una importante fuente de gas intestinal es el producido en el colon por la fermentación de los sustratos de la dieta no absorbidos en el intestino delgado, y esto depende también de la composición y actividad metabólica de la microbiota en cada individuo[46]. Así, resultados de estudios cuantitativos mediante cultivos y PCR del RNA bacteriano, han demostrado cambios en la microbiota de los pacientes con SII, con un aumento relativo de Firmicutes (principalmente Clostridium y Ruminococcaceae) y reducción de Bacteroidetes, Lactobacilli y Bifidobacteria[44],[47],[48]. Los metabolitos resultantes de la fermentación bacteriana también pueden contribuir al desarrollo de síntomas de SII. Tana et al.[47] encontraron, en un estudio comparativo en 26 pacientes con SII y 26 sujetos sanos, además de un cambio en la composición de la flora colónica, niveles significativamente más altos de ácidos orgánicos acético y propiónico en los pacientes con SII, encontrando además correlación entre la intensidad de los síntomas y los niveles de estos metabolitos. Finalmente, parece existir una interacción entre la dieta y la composición de la microbiota, ya que se ha demostrado que la introducción de una dieta flatulenta, además de incrementar la producción de gas y los síntomas abdominales, induce una inestabilidad en la composición de la microbiota en sujetos con SII, con cambios en los principales fila y reducción de la diversidad microbiana, mientras en sujetos sanos esta se mantiene estable[49].
8. Sobrecrecimiento bacteriano en la DA.
El sobrecrecimiento bacteriano del intestino delgado (SBID) consiste en la presencia de un excesivo número de bacterias en el intestino delgado, lo que da lugar a síntomas como diarrea, dolor y DA, como consecuencia de una excesiva fermentación bacteriana[50]. La prueba estándar oro para su diagnóstico es el recuento bacteriano en cultivo de aspirado yeyunal (patológico si >105 UFC/ml) si bien sus limitaciones a la hora de obtener, conservar y procesar la muestra, así como su carácter invasivo, han limitado considerablemente su uso. Como alternativa, los test del aliento (administrando glucosa o lactulosa), que permiten de forma no invasiva detectar el H2 y CH4 excretados producto de la fermentación bacteriana, son actualmente la prueba más utilizada (se considera patológico un aumento >20 ppm en los 60-90 minutos tras la administración del sustrato)[51].
En este sentido, la DA en el SII podría ser el resultado de un SBID[50]. En un estudio en 111 pacientes con SII utilizando test del aliento con lactulosa se encontró que un 84% tenían el test positivo (vs 20% controles) a la vez que existía una mejoría significativa de los síntomas (dolor, distensión y diarrea) tratando a los pacientes con neomicina durante siete días (35% vs. 11%), siendo la respuesta aún más evidente en el subgrupo de pacientes que normalizaban el test del aliento tras el tratamiento[52]. Posteriormente, varios estudios controlados aleatorizados (ECA) con rifaximina han puesto de manifiesto una mejoría sintomática significativa, en la misma línea del estudio anterior[53],[54]. Sin embargo, estos resultados se han cuestionado ampliamente[18],[44] por la baja fiabilidad del test del aliento con lactulosa, que puede reflejar más un tránsito rápido al ciego más que un verdadero SBID[55], por el bajo efecto placebo comparado con otros estudios y porque estos resultados no se han podido reproducir mediante cultivo de aspirado yeyunal[56].
No obstante, parece existir cierto acuerdo entre expertos de que, al menos en una proporción de pacientes con SII y DA, existe una excesiva fermentación bacteriana que puede contribuir a estos síntomas y que, en algunos casos, la existencia de un SBID podría jugar algún papel.
9. Los alimentos en la DA.
Existe cada vez más evidencia científica, cada vez más sólida, que apoya el papel de la dieta en el desarrollo de DA. Así, una dieta rica en fibra o hidratos de carbono no absorbibles (o poco absorbibles) incrementa la producción de gas en el intestino mediante un aumento de la fermentación[43] a la vez que se activan mecano y quimiorreceptores por el incremento de volumen intestinal derivado de su efecto osmótico)[9],[46],[57]. Paralelamente también pueden existir otros mecanismos de producción de síntomas como la activación del sistema inmune, que induciría inflamación mínima de la mucosa intestinal[58].
Casos especiales son las intolerancias a lactosa y fructosa, muy prevalentes entre los pacientes con SII y DA (51% lactosa, 60% fructosa y 33% ambos)[59], pero también en la población general. Así, las evidencias de que la intolerancia a la lactosa pueda jugar un papel en los síntomas de los pacientes con SII y DA son pobres pues además de no existir una mayor prevalencia en esta población, no se ha encontrado asociación entre el consumo de lactosa y los síntomas abdominales[10],[59],[60]. Sin embargo, sí hay algunos datos a favor de que la restricción de estos azúcares pueda mejorar los síntomas, sobre todo en el caso de la fructosa-sorbitol[59],[61],[62]. Wilder et al.[60] investigaron la prevalencia de intolerancia/malabsorción de fructosa y lactosa mediante test del hidrógeno y su asociación con síntomas gastrointestinales en 1.372 pacientes con SII, encontrando tasas de malabsorción a lactosa, fructosa y mixta de 45%, 32% y 16% respectivamente, además de la existencia de intolerancia sin malabsorción hasta en un 20% más de pacientes. También pusieron de manifiesto una mejoría de síntomas tras restricción dietética en el 50-80% de los intolerantes (independientemente de la existencia o no de malabsorción), lo que plantea la existencia de otros factores posiblemente implicados como la microbiota, la hipersensibilidad o el efecto gatillo.
Un papel importante desempeñan los denominados FODMAP (Fermentable Oligosaccharides, Disaccharides, Monosaccharides And Polyols)[57], un conjunto de carbohidratos cuya difícil absorción en el intestino delgado da lugar, de forma fisiológica, a su fermentación por las bacterias colónicas liberando grandes cantidades de gas y otros productos, como ácidos grasos de cadena corta, además de inducir la liberación de agua en la luz intestinal por un efecto osmótico, pudiendo producir síntomas en sujetos con SII, entre ellos DA[57],[63]-[65]. Ong et al.(64) vieron en un estudio aleatorizado cruzado mediante test del aliento en 30 sujetos (15 sanos y 15 con SII) que el consumo de una dieta rica en FODMAP se asociaba a un aumento en la producción intestinal de H2, si bien esta fue significativamente menor en sujetos sanos quienes, a diferencia de los pacientes con SII, no reportaron síntomas a pesar del gas producido. El concepto de FODMAP es relativamente nuevo pues implica considerar como un solo grupo, con efectos sumatorios[57],[65], distintos grupos de carbohidratos que anteriormente eran considerados de forma separada e independiente. Son:
a) Lactosa, disacárido formado por glucosa y galactosa que requiere para su absorción la hidrólisis por la lactasa intestinal, cuya presencia en el enterocito, genéticamente regulada, se va reduciendo progresivamente tras la lactancia, de manera que más del 70% de los adultos tienen hipolactasia.
b) Fructosa, monosacárido que, en presencia de glucosa, es absorbido eficientemente mediante el cotransportador glucosa-fructosa GLUT-2 en una proporción 1:1. Sin embargo, el exceso de fructosa (fructosa libre de glucosa), tiene una absorción limitada, a través de un transportador de baja capacidad (GLUT-5) y por el que, además, compite el sorbitol.
c) Fructanos y galactanos, oligosacáridos (polímeros de fructosa y de galactosa, respectivamente) para los que el intestino humano carece de enzimas y que, por tanto, no se absorben.
d) Polioles, alcoholes derivados del azúcar (sorbitol, manitol, maltitol, xilitol, isomaltosa) que se absorben en porcentaje muy variable de unos individuos a otros mediante difusión pasiva (se estima que al menos el 70% no son absorbidos en el intestino delgado).
En la práctica, son alimentos con alto contenido en FODMAP[57] cereales como el trigo, el centeno y la cebada, frutas como la manzana, la pera, la sandía, el melocotón, las cerezas, las moras, las nectarinas o el mango, verduras y hortalizas como la cebolla, el ajo, las alcachofas, los espárragos, las coles de Bruselas, el brócoli, la coliflor o los champiñones, legumbres como guisantes, alubias, lentejas, garbanzos o soja así como los lácteos, la miel y edulcorantes artificiales como el sorbitol (Tabla 3).
Tabla 3
Alimentos ricos en FODMAP.
[i] Lista de abreviaturas. FODMAP: Fermentable Oligosaccharides, Disaccharides, Monosaccharides and Polyols. Adaptado de Khan et al.[57].
Es importante reseñar de nuevo que los FODMAP o no se absorben o se absorben parcialmente, por lo que su presencia en el intestino delgado distal y colon proximal es fisiológica, dando lugar a la producción de gas y otros productos en todos los individuos, por lo que, por sí solos, no son los responsables de los síntomas de los pacientes con SII y DA.
10. Resumen de la fisiopatología de la DA.
De todo lo expuesto, podemos concluir que la fisiopatología de la DA responde a la interacción de diversos factores, cada uno de ellos con un peso distinto en función de variaciones individuales. Así, pequeños acúmulos de gas (u otros componentes del contenido intestinal) provenientes, por ejemplo, de la fermentación bacteriana, pueden originar en sujetos con una alteración del aclaramiento intestinal una distensión segmentaria del tubo digestivo relativamente leve (que no llega a producir un aumento sustancial del volumen intraabdominal) pero suficiente para inducir respuestas reflejas viscerosomáticas anómalas (disinergia abdominofrénica) y síntomas, particularmente en individuos con hipersensibilidad visceral[8],[18],[33],[66].
Estudio del paciente con DA
No existen guías de consenso validadas para el diagnóstico del paciente con DA, por lo que es esencial seguir con sentido común nuestros conocimientos sobre el diagnóstico del SII. El primer paso es siempre descartar una enfermedad orgánica, pues no debemos perder de vista que la DA puede ser un signo/síntoma de cualquier otra enfermedad. Por supuesto, deberemos asegurarnos de si la DA es el síntoma principal o es parte de un cuadro clínico con otros síntomas guía que permitan una orientación diagnóstica adecuada (diarrea, estreñimiento, hematoquecia, etc.)[66]. Es esencial la elaboración de una historia clínica cuidadosa y exploración física completa, siempre orientadas a la detección de signos o síntomas de alarma (anemia, pérdida de peso involuntaria, hematoquecia, adenopatías, masa abdominal, etc.) o bien la existencia de antecedentes familiares de enfermedad celíaca o cáncer colorrectal. Además, la entrevista clínica debe recabar aspectos clave como el tiempo de evolución de los síntomas, la relación de estos con la dieta (por ejemplo, lácteos, fructosa, fibra, azúcares no absorbibles, etc.), con el hábito intestinal, si hay o no ritmo circadiano típico, la presencia de otros síntomas sugestivos de patología funcional, etc. Además, es recomendable un estudio básico de laboratorio que incluya hemograma, serología celíaca, perfil férrico y hormonas tiroideas, e incluso una radiografía simple de abdomen para cuantificar el gas visible intraabdominal. Caso de existir alguna alteración analítica o algún signo/síntoma de alarma sería entonces necesario realizar alguna prueba complementaria (gastroscopia con toma de biopsias duodenales, colonoscopia, ecografía, etc.) para excluir patología orgánica[21],[66]. A partir de aquí, quedaría establecido el diagnóstico de trastorno funcional intestinal y utilizamos los criterios clínicos para tratar de clasificar al paciente dentro de una categoría concreta conforme a la clasificación Roma IV (SII, estreñimiento funcional, diarrea funcional, distensión funcional, etc.)[5],[67].
También deberíamos prestar atención a la presencia de factores patogénicos claramente reconocibles que puedan influir claramente en la aparición de DA y que sean potencialmente tratables, tales como enlentecimiento del vaciamiento gástrico, estreñimiento, disinergia del suelo pélvico, etc. así como posibles intolerancias alimentarias tales como malabsorción de lactosa y/o fructosa-sorbitol mediante test del aliento.
Tratamiento
No existen guías específicas ni algoritmos basados en la evidencia para tratar a estos pacientes. Hay que tener en cuenta que, aunque las evidencias disponibles, son muy numerosas, estas son por lo general extrapolaciones de resultados de estudios en pacientes con SII en los que la mejoría de la DA no era un objetivo primario. A ello hay que añadir limitaciones derivadas de la heterogeneidad de los estudios, con distintos grupos, definiciones, objetivos, mediciones de resultados, etc. que condicionan su interpretación.
En cualquier caso, si tratamos de enfocar el tratamiento de estos pacientes con arreglo a los conocimientos fisiopatológicos de la DA, queda claro que este debe comprender multitud de aspectos, cada uno con un peso variable en cada individuo. Ello nos lleva a un enfoque terapéutico individualizado y orientado a reducir la producción de gas y/o acelerar el tránsito intestinal y/o mejorar la tolerancia-acomodación (Tabla 4)[66].
Tabla 4
Abordaje terapéutico de los pacientes con DA.
1. Medidas dietéticas y estilo de vida.
Se considera una opción de primera línea[33]. Se sabe que los pacientes con SII que toman una dieta flatulenta tienen mayor producción y retención de gas, más síntomas y más DA objetiva que aquellos que toman una dieta poco flatulenta[11],[43],[49],[68] por lo que una dieta pobre en fibra y sustratos fermentables puede ser beneficiosa para estos pacientes. En este sentido, Azpiroz et al.[46] compararon el efecto de una dieta no flatulenta frente a una dieta estándar mediterránea en 30 sujetos con DA, y observaron que la dieta no flatulenta ocasionaba menor número de evacuaciones de gas (un 54% frente a 28% el grupo control), menor DA (medida por TC, 48% vs. 22%) y menos síntomas. Se trata de que los pacientes limiten el consumo de legumbres (garbanzos, lentejas, alubias, etc.), verduras y hortalizas (como la coliflor o el brócoli) así como cereales integrales, evitando también bebidas gaseosas y edulcorantes artificiales. Posteriormente se recomienda evaluar el efecto de esta modificación dietética, al menos una semana después de haberse instaurado, pudiendo, una vez obtenida la mejoría sintomática, reintroducir algunos alimentos progresiva y ordenadamente para identificar aquellos que desencadenen síntomas y así decidir si merece la pena mantener la dieta[33]. Todo ello choca con la recomendación clásica de seguir una dieta rica en fibra dirigida a los pacientes con SII quienes, por lo general, suelen consumirla en grandes cantidades en un intento de mejorar sus síntomas.
En esta línea se encuentra la Dieta Saludable del National Institute for Health and Care Excellence (NICE)[69],[70], diseñada para reducir los síntomas del SII y que incluye restricciones dietéticas limitando el consumo de fibra y alimentos flatulentos, además de otras recomendaciones saludables (Tabla 5). Esta dieta ha mostrado tasas de mejoría sintomática entre 41-46% tras cuatro semanas en ECA recientes que la comparaban con la dieta baja en FODMAP, de la que hablaremos más adelante, mostrando incluso en uno de ellos ser igual de efectiva[71],[72].
Tabla 5
Recomendaciones dietéticas y hábitos saludables del NICE para el tratamiento de los síntomas del SII.
Además, es recomendable evitar el sedentarismo, ya que, al igual que ocurre con el estreñimiento, hay evidencias de que la actividad física suave mejora el tránsito y la evacuación de gas, reduciendo la DA[73]. Villoria et al.[74], en un estudio en sujetos con SII y DA a los que sometieron a infusión de gas y lípidos en el yeyuno en reposo y mientras pedaleaban en una bicicleta estática, observaron que, durante el ejercicio, los pacientes retuvieron una cantidad significativamente menor de gas a la vez que disminuía la DA.
2. Dieta baja en FODMAP.
Últimamente ha ido apareciendo numerosa evidencia científica de calidad que apoya el papel de la dieta baja en FODMAP en el tratamiento de los síntomas del SII, habiéndose demostrado una reducción de síntomas globales, especialmente la distensión, el dolor abdominal y la diarrea, siendo el síntoma que menos mejora el estreñimiento[57],[75]. Así, existen numerosos ECA (aunque sólo tres midieron la DA, como objetivo secundario) analizando la eficacia de la dieta baja en FODMAP en pacientes con SII. Todos ellos, a pesar de diferir entre sí notablemente en su diseño y metodología, han mostrado una mejoría significativa en la puntuación de los síntomas, con una tasa de respuesta entre 50-86%[64],[71],[72],[75]-[77]. Halmos et al.[75], en un ECA cruzado a lo largo de 21 días en 38 sujetos con SII mostraron una reducción en la producción de H2 y una mejoría en los síntomas abdominales y de la DA, frente a una dieta estándar igualada en proporción de nutrientes salvo en la cantidad de FODMAP. Estos hallazgos se reprodujeron cuando, tras un período de lavado de otros 21 días, los sujetos fueron asignados a la otra dieta. Todos estos estudios se recogieron en dos metaanálisis que confirmaron la efectividad de la dieta baja en FODMAP[57],[78], con un NNT=2[57], obteniéndose, cuando se desglosaban los síntomas, una mejoría significativa en el caso de la DA (OR=1,7) y el dolor abdominal (OR=1,8)[78].
Una vez instaurada, se recomienda mantener la dieta unas 6-8 semanas, transcurridas las cuales se debe valorar la respuesta clínica. Si hay mejoría sintomática evidente, se puede valorar reintroducir poco a poco algunos de los alimentos eliminados, por grupos y de forma no sumatoria, para evitar el efecto aditivo, con el fin de identificar aquellos que producen síntomas en cada paciente y reconocer el dintel de tolerancia individual para cada grupo[65], si bien hay que tener en cuenta que se trata de un planteamiento empírico sobre el cual no existen evidencias. Lógicamente todo este proceso requiere de una gran motivación por parte del paciente, además de la ayuda de un dietista experto y el seguimiento de un médico.
Los aspectos más controvertidos de esta dieta están en relación con la falta de evidencias acerca de su eficacia a medio y largo plazo (más allá de 6-8 semanas) y la seguridad de una restricción alimentaria tan extensa[57],[65]. Preocupan especialmente la posibilidad de déficits nutricionales, la alteración de la composición de la microbiota (reducción de bifidobacterias) observada en estudios a corto plazo e incluso la posibilidad de un eventual aumento del riesgo cardiovascular o de cáncer colorrectal por la reducción en la ingesta de fibra y una menor producción de butirato[79]. También se ha criticado que otras intervenciones dietéticas han mostrado eficacia similar; así, un estudio multicéntrico sueco[72] en 75 pacientes con SII que fueron asignados a dieta baja en FODMAP o recomendaciones tradicionales para SII encontró que ambas estrategias redujeron los síntomas de SII tras cuatro semanas, sin diferencias entre ambos grupos (50% vs. 46%).
De todo ello se puede concluir que la dieta pobre en FODMAP es una opción terapéutica en el tratamiento del SII y, por extensión, en la DA. No obstante, dadas sus limitaciones de cara a su instauración en la práctica clínica habitual, así como los interrogantes sobre su eficacia y seguridad a largo plazo, esta debe recomendarse con cautela, teniendo en cuenta que puede ser incluso más práctico la exclusión dirigida de lactosa/fructosa-sorbitol junto a las recomendaciones dietéticas NICE.
3. Corrección del estreñimiento.
Es importante corregir el estreñimiento en estos pacientes, con medidas que no incrementen la producción de gas, evitando el exceso de fibra y los laxantes osmóticos fermentables (como la lactulosa y el lactitol) ya que incrementan la producción de gas intestinal, siendo preferibles fármacos como el macrogol. También se puede recurrir a fármacos procinéticos como prucaloprida y fármacos estimuladores de la secreción intestinal de fluidos como linaclotida, que serán revisados más adelante[80]. Complementariamente, en caso de defecto expulsivo, el biofeedback anorrectal puede ser muy útil[80].
4. Biofeedback abdominotorácico.
Los pacientes con DA tienen una respuesta refleja anormal de acomodación de la musculatura de la pared abdominal, con contracción paradójica del diafragma y relajación del músculo oblicuo interno denominada disinergia abdomino-frénica[32]. Este concepto abre la posibilidad de que la DA pueda mejorar mediante biofeedback, una técnica de entrenamiento que permite un control visual de la actividad muscular abdominotorácica mediante electromiografía por parte del paciente. Así, en cada sesión, el paciente es instruido para reducir la actividad de músculos intercostales y diafragma a la vez que incrementa la de abdominales anteriores. Se ha planteado, de manera análoga al biofeedback anorrectal, realizar al menos tres sesiones a lo largo de 1-2 semanas[81].
Barba et al.[81], en un grupo de 45 pacientes con SII y DA, a los que sometió a sesiones de biofeedback a lo largo de diez días observó que este redujo la actividad diafragmática un 18%, activó los músculos oblicuos internos un 52% y redujo la circunferencia abdominal 25 mm (p≤0,009) comparado con la situación basal, antes de iniciar el tratamiento. Estos hallazgos han sido corroborados por el mismo grupo en un ECA frente a placebo en 48 pacientes con SII[82] en el que los pacientes tratados con biofeedback consiguieron incrementar la actividad muscular de la pared abdominal (101% vs. 4%, p<0,001) a la vez que se redujo la puntuación de DA (56% vs. 13%, p<0,001). Además, los pacientes placebo fueron posteriormente reasignados a biofeedback obteniendo a su vez cambios clínicos y electromiográficos significativos.
Por tanto, el biofeedback puede ser un abordaje terapéutico adecuado en pacientes con DA, quedando por ver cómo se puede extender su utilización e implementar en la práctica clínica habitual.
5. Tratamiento farmacológico.
Debemos tener en cuenta que los distintos estudios disponibles se centran en el tratamiento de pacientes con SII y diversos síntomas (no solo DA), siendo esta, en su mayoría, una variable secundaria, con las limitaciones que esto conlleva. A modo de resumen podemos afirmar que las evidencias más sólidas se han encontrado con lubiprostona, linaclotida, rifaximina y algunos probióticos (Bifidobacterium)[83].
5.1. Rifaximina.
Ya ha sido analizada la posible existencia de un SBID en los pacientes con SII[50], por lo que la utilización de antibióticos no absorbibles como la rifaximina, un derivado de la rifampicina con muy buen perfil de seguridad, podría ser de utilidad. En un estudio en 111 pacientes con SII utilizando test del aliento con lactulosa Pimentel et al.[52] encontraron que hasta un 84% de los pacientes con SII tenían el test positivo (frente a un 20% en controles) a la vez que mejoraban significativamente los síntomas (dolor, distensión y diarrea) tratando con neomicina durante una semana (35% vs. 11%), siendo la respuesta aún más evidente en el subgrupo de pacientes que normalizaban el test. En esta línea, existen tres ECA frente a placebo, que obtuvieron una mejoría sintomática con rifaximina, en especial, la DA. En el primero de ellos 87 pacientes fueron aleatorizados a recibir rifaximina 1.200 mg/día durante diez días frente a placebo y se puso de manifiesto una mejoría sintomática significativa (36% vs. 21%) que se mantenía a lo largo de 10 semanas de seguimiento, a expensas de una mejoría en el síntoma DA (frente a dolor, diarrea y estreñimiento)[53]. El segundo de ellos, con diseño muy similar, en 122 pacientes, encontró mejoría significativa en el grupo tratado (41% vs. 23%) que, además, se correlacionaba con la respuesta medida mediante test del aliento con lactulosa[84]. El tercero, incluía 1.258 pacientes tratados con 1.650 mg/día de rifaximina durante 14 días seguidos 10 semanas, encontrando una tasa de respuesta sintomática global de 41% (vs. 31% placebo; p<0,001) y, en el caso de la DA, de 39% (vs. 29% placebo; p<0,001), persistiendo estas diferencias a lo largo de todo el período de observación[54]. Sin embargo, todos estos resultados han sido muy cuestionados por la falta de validación y fiabilidad del test del aliento con lactulosa, que podría reflejar más bien un tránsito rápido al ciego y no un SBID, además de por las estrechas diferencias en la tasa de respuesta frente a placebo (sólo 10%), la cual parece a su vez excesivamente baja en comparación con otros estudios en SII[18],[44],[55],[85]. A todo esto, se añade la preocupación sobre algunos potenciales efectos relacionados con su uso a largo plazo, no aclarados en la actualidad, como la posible aparición de resistencias bacterianas y el potencial efecto favorecedor de la colonización e infección por Clostridium difficile[44].
En cualquier caso, un curso corto puede tener utilidad en algunos pacientes con SII, teniendo en cuenta que, al menos una proporción de pacientes con SII y DA tiene una excesiva fermentación bacteriana que puede contribuir a estos síntomas.
5.2. Probióticos.
Los probióticos se definen como aquellos microorganismos vivos que confieren un beneficio para la salud al huésped cuando se administran en una dosis adecuada[86]. Aunque su mecanismo de acción no es bien conocido, los probióticos parecen tener un potencial efecto sobre la estabilidad de la microbiota intestinal, cuya cantidad y composición parece estar alterada en los pacientes con SII[44]-[48]. Además, parecen tener efectos específicos de especie (diferentes síntomas responden a diferentes probióticos) de manera que el dolor y la distensión parecen responder mejor a Bifidobacterium infantis 35624, Bifidobacterium lactis DN-173 010, Lactobacillus casei shirota y Lactobacillus rhamnosus GG[87].
Existen numerosos los estudios acerca de la eficacia de los probióticos en el tratamiento de los síntomas de los pacientes con SII, algunos de los cuales tienen incluso como objetivo primario la DA[88]-[90]. Así, un ECA de 2005 en 45 pacientes mostró que la combinación VSL# 3 redujo un 25% las puntuaciones de DA en el grupo tratado (no así otros síntomas de SII)[88]. Agrawal et al.[89], en otro ECA en 34 pacientes con SII tratados con Bifidobacterium lactis DN-173 010 encontraron cambios significativos frente al grupo tratado con placebo, tales como una reducción en la DA objetiva un 39%, una aceleración del tiempo de tránsito orocecal y colónico, y una mejoría de la sensación de DA. Finalmente, otro ECA con Lactobacillus acidophilus y Bifidobacterium lactis en 70 pacientes tratados durante ocho semanas obtuvo también una mejoría significativa en la DA frente a placebo[90]. Estos y otros estudios fueron recopilados en varios metaanálisis[91],[92] destacando el de Ford et al.[92], que incluyó 35 ECA sobre un total de 3.452 pacientes con SII (17 estudios y 1.446 pacientes analizaron la variable DA), observando que los probióticos tuvieron efecto beneficioso tanto en la puntuación global de síntomas (NNT=7) como en la puntuación de la DA. A partir de aquí, no queda claro, dada la heterogeneidad de los mismos y la variedad de combinaciones utilizadas en muchos de ellos, qué especie puede ser más beneficiosa en el tratamiento de la DA, si bien parece existir tendencia a favor en el caso de Bifidobacterium.
En cualquier caso, se puede considerar que los probióticos pueden ayudar a reducir la DA al menos en algunos pacientes con SII, con un nivel moderado de evidencia, y, por tanto, pueden intentarse en el tratamiento de la DA por un período de al menos un mes.
5.3. Fármacos reductores del gas intestinal.
Son el grupo más ampliamente usado, formado por la simeticona y el carbón activado. Se piensa que alteran la elasticidad de las burbujas de gas y facilitan así su evacuación. Sinembargo, los datos sobre su eficacia son escasos y limitados[93].
5.4. Fármacos favorecedores del tránsito y la evacuación.
Básicamente, son los fármacos procinéticos, que actúan por diversos mecanismos estimulando la motilidad intestinal. Así, se ha visto experimentalmente que, en pacientes con retención de gas inducida mediante infusión yeyunal, la estimulación de la motilidad mediante neostigmina a dosis bajas (0,5 mg i.v.) redujo de forma significativa la retención de gas, los síntomas abdominales y la DA comparado con placebo[25],[36]. Los más estudiados han sido los agonistas 5-HT4 cisaprida y tegaserod. Mientras en el caso de cisaprida los resultados sobre su efecto en la DA han sido poco consistentes, tegaserod sí ha mostrado ser eficaz en el tratamiento de los síntomas de SII y, en particular, la DA[94]. Sin embargo, ambos fueron retirados del mercado por su potencial de efectos adversos cardiovasculares graves, quedando únicamente disponibles otros fármacos como cinitaprida o levosulpiride, cuyas evidencias avalan su uso más bien en el tratamiento de la dispepsia funcional-síndrome de distrés postprandial[83],[95],[96]. En los últimos años ha aparecido la prucaloprida, otro agonista 5-HT4 con potente actividad procinética que ha demostrado su eficacia en el tratamiento del estreñimiento funcional con un buen perfil de seguridad[80],[97] y que también puede mejorar algunos síntomas como la DA. Así, Tack et al.[98], en un ECA en 936 mujeres con estreñimiento funcional tratadas con 2 mg diarios de prucaloprida durante 12 semanas obtuvieron una mejoría sintomática global y, secundariamente, en la puntuación de los síntomas DA y dolor, frente a placebo.
5.5. Fármacos favorecedores de la tolerancia intestinal.
Los espasmolíticos reducen el tono y la contractilidad del músculo liso intestinal, pudiendo tener un efecto beneficioso en el tratamiento de la DA porque incrementan la compliance del intestino mejorando la tolerancia al gas intestinal. De hecho, experimentalmente se ha visto que la reducción de la actividad motora intestinal en sujetos sanos mediante la administración de glucagón intravenoso aumenta la tolerancia a la retención de gas inducida mediante infusión yeyunal, siendo la percepción de los síntomas mucho menor[40].
Entre estos fármacos se encuentran la escopolamina, hioscina, mebeverina, pinaverio, trimebutina y bromuro de otilonio. Numerosos estudios y varios metaanálisis analizan su eficacia, aunque con una gran heterogeneidad tanto en el diseño y como en los resultados. En un metaanálisis que recogía 23 ECA y un total de 1.888 pacientes con SII (de los cuales sólo seis con 887 pacientes tenían como objetivo secundario el efecto sobre la DA) se puso de manifiesto la eficacia de los espasmolíticos en su conjunto (como grupo) en el tratamiento tanto de los síntomas globales de SII (56% vs. 38%, OR=2,13) como de la DA (44% vs. 35%; OR=1,46), frente a placebo[99]. Otros metaanálisis han puesto igualmente de manifiesto la eficacia de los espasmolíticos en el SII (NNT=5) siendo los más eficaces hioscina y bromuro de otilonio, si bien no se analizó separadamente la DA[100]. En el caso del aceite de pipermín, un aceite natural con propiedades relajantes de la musculatura lisa intestinal, este último metaanálisis (NNT=2,5) y otros también han mostrado su eficacia, aunque no específicamente en DA[101].
5.6. Estimulantes de la secreción de fluidos.
Son fármacos que inducen un aumento de la secreción de agua y cloro hacia la luz intestinal con la consiguiente estimulación del tránsito intestinal. Destacan lubiprostona y linaclotida.
La lubiprostona es un derivado prostaglandínico que estimula la secreción de agua y cloro hacia la luz intestinal a través de la activación de los canales del cloro CIC-2 de la membrana del enterocito. Su eficacia en el tratamiento del SII-E se ha puesto de manifiesto en varios estudios con un buen perfil de seguridad[102], habiendo mostrado además efectos beneficiosos en el tratamiento de la DA. Así, en un reciente ECA en 405 pacientes con SII-E tratados con lubiprostona durante 12 semanas se obtuvo una mejoría significativa en la DA (reducción >30% en las puntuaciones de DA) frente a placebo (32% vs. 19%; p<0,001)[103]. En la actualidad, el fármaco (aprobado por las agencias del medicamento americana y europea) no está comercializado en España.
La linaclotida, por su parte, es una agonista de la guanilato ciclasa C que, además de estimular la secreción intestinal de agua y cloro, disminuye la sensibilidad visceral, y que sí está disponible en nuestro país. Existen evidencias sólidas acerca de su eficacia en el tratamiento del SII-E, consiguiendo mejorar la frecuencia y consistencia de las deposiciones, además de mejorar los síntomas abdominales, incluyendo la DA[104]. Más concretamente, su eficacia en el tratamiento de la DA se analizó en un reciente ECA en 483 pacientes con SII-E que presentaban DA moderada-severa, encontrando respuesta sintomática en el 41% de los pacientes tratados (frente a 29% en el grupo placebo; p<0,01) al final de las 12 semanas de tratamiento[105].
5.7. Antidepresivos.
Finalmente, los fármacos antidepresivos como la amitriptilina, la fluoxetina o el citalopram se han mostrado eficaces para el tratamiento de los síntomas de los pacientes con SII por su efecto antinociceptivo y modulador de la motilidad intestinal. Sin embargo, la información disponible sobre los efectos sobre la DA es escasa y contradictoria[83].
Conclusiones
Los pacientes con DA presentan una alteración en los mecanismos de producción, tránsito y evacuación del contenido intestinal. A ello se añaden otros fenómenos como la hipersensibilidad visceral y la disinergia abdominofrénica, que favorecen que pequeños incrementos en el volumen intraabdominal sean suficientes para producir síntomas, con o sin DA objetiva. El enfoque diagnóstico de estos pacientes se centra en descartar la existencia de patología orgánica, mediante una historia clínica y exploración física completas, además de la realización de un estudio analítico básico. La DA puede tratarse con medidas dietéticas como la reducción en la ingesta de carbohidratos fácilmente fermentables (recomendaciones NICE, dieta baja en FODMAP, reducción en la cantidad total de fibra ingerida, etc.). Fármacos como la rifaximina pueden tener utilidad en algunos pacientes (especialmente aquellos con excesiva fermentación bacteriana), al igual que los probióticos; otros fármacos también pueden ser útiles, como procinéticos, espasmolíticos y estimulantes de la secreción como linaclotida. Finalmente, técnicas como el biofeedback abdominotorácico han mostrado resultados prometedores.

 Descargar número completo
Descargar número completo Download full issue
Download full issue