CITA ESTE TRABAJO
Bellido Muñoz F. Hipertensión portal. Patogénesis, diagnóstico y tratamiento. RAPD Online. 2022;45(5):165-174.
Introduction
La hipertensión portal (HP) es un síndrome clínico que se caracteriza por un incremento en el gradiente de presión venoso hepático portal (GPVH), definido como el gradiente entre la vena porta y la vena cava inferior. El valor habitual del GPVH se encuentra entre 1 y 5 mm Hg. A partir de 5 los valores obtenidos indicarán la presencia de HP, siendo su causa mayoritaria la cirrosis hepática. A partir de valores de 10 mm Hg se considera HP clínicamente significativa dado que se asocia a eventos clínicos derivados tales como el desarrollo de varices esofagogástricas (VEG) y descompensaciones de la enfermedad hepática basal (ascitis, hemorragia por varices y/o encefalopatía)[1].
La principal causa de HP es la cirrosis hepática, siendo el máximo precipitante de generar dichas complicaciones clínicas graves que pueden llevar a la muerte del paciente; pero, también puede acontecer HP en ausencia de cirrosis, situación en la cual hablamos de HP no cirrótica.
Tanto en la HP cirrótica y no cirrótica el objetivo es diagnosticar y caracterizar su gravedad a fin de minimizar las complicaciones potencialmente graves y mortales. El objetivo de esta revisión será aproximarnos a las generalidades, clasificación, diagnóstico y manejo de este síndrome, para lo cual es importante comenzar entendiendo su fisiopatología.
Patogénesis
Tal y como ocurre en cualquier sistema vascular, por analogía hidráulica, la presión venosa portal sigue la ley de Ohm que describe como un fluido se desplaza en el interior de un conducto cuando la presión en el inicio es superior a la presión a la existente al final de este, moviéndose desde una zona de mayor a menor presión . Así, el flujo (Q) depende directamente del gradiente de presión entre esos dos puntos (ΔP) e inversamente de la resistencia (R). Ésta última dependerá de la dimensión del conducto y de la naturaleza del fluido, midiendo las fuerzas de fricción entre las propias moléculas del fluido, y entre éstas y las moléculas de la pared del conducto (ΔP: Q X R).
En todas las etiologías de la HP lo primero que acontece es un aumento de las resistencias al flujo sanguíneo portal, seguido de un incremento de dicho flujo. Dependiendo del sitio donde se incrementa dicha resistencia es donde se encuentra la base de la clasificación clásica de la HP[2].
Clasificación de la hipertensión portal
La HP es causada por una obstrucción en el flujo sanguíneo portal y puede ocurrir en diferentes niveles del sistema venoso portal. La presión en la vertiente proximal a la obstrucción estará aumentada, mientras que a nivel distal será normal. En función del lugar de la interrupción del flujo venoso se clasifica en prehepática (si ocurre en vena esplénica, vena porta antes de su llegada al hígado, o vena mesentérica), intrahepática (obstrucción al flujo en el interior hepático) y poshepática (obstrucción en el flujo venoso de salida).
Hipertensión portal prehepática
A pesar de ser la cirrosis la principal causante de trombosis en el eje portal, la trombosis venosa sin hepatopatía subyacente también genera una alteración del flujo sanguíneo portal, considerándose la segunda causa más común de HP. Esta entidad se relaciona con síndromes mieloproliferativos, cirugías y estados proinflamatorios generados en diferentes órganos del sistema digestivo y del bazo. Las cirugías bariátricas, esplenectomías, pancreatitis, enfermedad inflamatoria intestinal, apendicitis o diverticulitis se caracterizan por ser importantes factores de riesgo para desarrollar una obstrucción extrahepática del flujo venoso portal; encontrándose a su vez en el 30% de estos pacientes un trastorno trombofílico sistémico de base[3]. Aun así, hasta en el 35% de las ocasiones puede existir una ausencia de factores de riesgo que se relacionen con la génesis de la trombosis portal (Tabla 1).
Tabla 1
Hipertensión portal prehepática.
Hipertensión portal intrahepática
El aumento de la resistencia vascular intrahepática se puede localizar a nivel de los capilares presinusoidales, sinusoidales o postsinusoidales. Las principales causas de HP presinusoidal incluyen la hiperplasia nodular regenerativa, esquistosomiasis, sarcoidosis, colangitis biliar primaria, colangiopatía autoinmune, fibrosis hepática congénita, y enfermedad poliquística del adulto. La cirrosis hepática es la primera causa de HP sinusoidal, pudiendo estar relacionada también con trastornos infiltrativos como la amiloidosis, mastocitosis y enfermedad de Gaucher. La HP postsinusoidal está principalmente causada por la enfermedad venooclusiva[4] (Tablas 2, 3 y 4).
Tabla 2
Hipertensión portal intrahepática presinusoidal
Tabla 3
Hipertensión portal intrahepática sinusoidal
Tabla 4
Hipertensión portal intrahepática sinusoidal
Hipertensión portal posthepática
Se produce generalmente por deterioro en el flujo venoso de salida hepático al aumentarse la resistencia a este nivel. La causa más común es el síndrome de Budd Chiari y la insuficiencia cardiaca derecha secundaria a determinadas condiciones como pericarditis, cardiomiopatías restrictivas, y/o cardiopatías congénitas[5] (Tabla 5).
Diagnóstico de la hipertensión portal
Aunque el diagnóstico definitivo de hipertensión portal requiere el uso de métodos invasivos, aún se puede hacer un diagnóstico más o menos preciso basado en la presencia de complicaciones relacionadas con la hipertensión portal y la exclusión de otras posibles causas. Varices esofagogástricas, esplenomegalia, trombocitopenia relacionada con hiperesplenismo, encefalopatía y síndrome hepatopulmonar pueden ser manifestaciones comunes de la HP clínicamente significativa. Dado que la función hepática y la presión sinusoidal suele ser normal en pacientes con HP prehepática y presinusoidal, la ascitis no es la principal característica clínica en estos pacientes, al contrario de lo que ocurre en la HP sinusoidal y postsinusoidal donde el desarrollo de ascitis suele ser una condición sine qua non acompañada de datos de insuficiencia hepática. Todo ello, combinado con determinadas características bioquímicas y/o radiológicas pueden llevar al diagnóstico. En la cirrosis hepática que constituye el 90 % de las etiologías de HP, raramente es necesario una evaluación invasiva de la presión portal para llegar al diagnóstico del síndrome de hipertensión portal[6].
El sistema venoso portal se encuentra ubicado entre dos lechos capilares como son los sinusoides hepáticas y los capilares esplácnicos, por lo que su acceso directo es muy complicado habiéndose establecido históricamente diferentes enfoques invasivos para conseguir una medición óptima de la presión portal. Actualmente contamos con diferentes pruebas diagnósticas tanto invasivas como no invasivas que nos ayudan a diagnosticar el síndrome de hipertensión portal independientemente de su etiología y la estratificación del riesgo de desarrollar complicaciones clínicas que influyan en la morbimortalidad del paciente.
Test invasivos diagnóstico hipertensión portal
Gradiente de presión venosa hepático (GPVH).
La primera medición de presión portal se realizó en 1937, insertando un catéter de aguja directamente en una rama de la vena porta en el transcurso de una cirugía abdominal[7]. Con el paso del tiempo se han propuesto otros abordajes directos como la cateterización de la vena umbilical o la de una rama de la vena porta por vía transhepática percutánea[8]. Hay que tener en cuenta que la medición de la presión portal directamente en la vena porta o en uno de sus brazos puede proporcionar unos resultados incorrectos puesto que la medida se puede ver afectada por la posición del transductor de presión y los aumentos en la presión intraabdominal (por ejemplo, cuando el paciente tiene ascitis). Estas técnicas desafiantes son invasivas, poseen potenciales riesgos, y si se realizan bajo anestesia general se puede artefactar el resultado debido al efecto de la sedación profunda sobre la hemodinámica esplácnica. Actualmente, las mediciones de presión venosa portal se están realizando de forma rutinaria durante la colocación de un TIPS, sin embargo, en estos casos siempre se debe realizar restando la presión de la vena cava inferior, reflejando así de forma correcta un gradiente de presión. Las indicaciones de la colocación de un TIPS son muy específicas, y el enfoque transyugular para medir tan sólo presión portal parece demasiado invasivo.
El GHPV se considera el método indirecto más común utilizado para evaluar la presión portal y se considera el gold standar. Su resultado proviene de la diferencia entre la presión venosa hepática libre (PVSL), una medida de la presión sistémica, y de la presión venosa hepática en cuña o enclavada (PVSE), una medida de la presión sinusoidal hepática. Este sistema se describió por primera vez en 1951[9]. En 1979, Groszmann describió de nuevo el método pero añadiendo el uso de un catéter con globo en lugar de un catéter recto que permitía ocluir con facilidad la vena hepática y así poder obtener mediciones repetidas tanto de presión libre como ocluida del vaso[10].
Habitualmente, la técnica se realiza en una sala de radiología vascular tras comprobar ecográficamente la permeabilidad de la vena yugular interna derecha, se procede a la introducción de un catéter guiado por guía hidrofílica hasta la vena cava inferior y posteriormente una cateterización selectiva de la vena suprahepática más accesible. De tal forma se mide la PVSL manteniendo el extremo distal del catéter en la vena suprahepática a 2-3 cm de su desembocadura en la vena cava inferior. La PVSE se mide posicionando el catéter lo más distal posible, ocluyendo la vena y comprobando su posición inyectando un pequeño volumen de contraste que nos permite comprobar la correcta oclusión y excluir la presencia de comunicaciones hepáticas venosas que pudieran infraestimar la presión enclavada reportada. En los últimos años se utiliza un balón para ocluir la vena, puesto que se suele ajustar de forma más adecuada al vaso, reduciendo el error aleatorio, y prefiriéndose por tanto frente al catéter recto. La diferencia entre las medidas de la PVSL y PVSE será el GPVH.
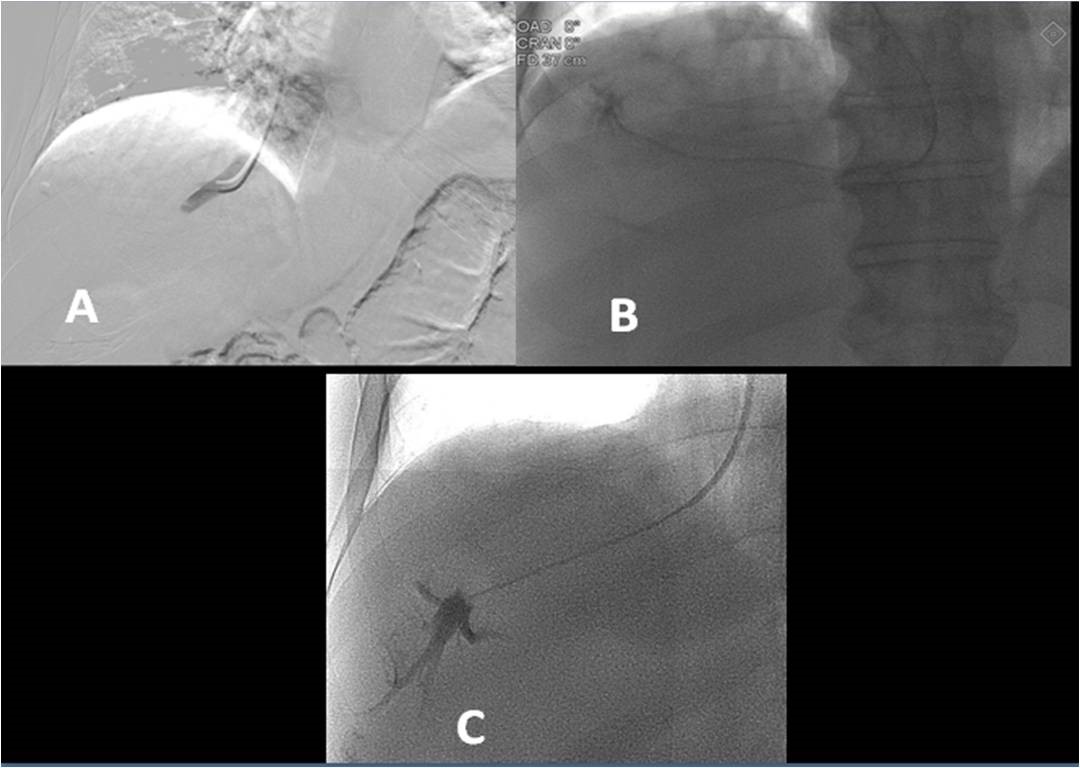
Se recomienda si existe sedación durante el procedimiento que sea a menor dosis posible, sobre todo con midazolam (0,02 mg/kg) para intentar evitar un valor incorrecto del gradiente. La sedación referida es aceptable puesto que no genera ninguna modificación del valor. Las mediciones deben hacer al menos en un número de tres y se debe mantener el catéter al menos durante un minuto en cada medida[11 ](Figura 1).
Figura 1
Medición del gradiente de presión venosa hepático. La presión venosa suprahepática libre se mide manteniendo el extremo distal del catéter en la vena suprahepática 2-4 cm de su desembocadura en la vena cava inferior (imagen A). La presión de la vena suprahepática enclavada se mide posicionando el catéter más distal ocluyendo la vena (imagen B). También se puede utilizar un balón para ocluir la vena (imagen C). La correcta oclusión se puede confirmar inyectando contraste (imagen B y C).
Existen datos que han demostrado una clara correlación entre los resultados de la PVSE con los obtenidos a través de una medición directa de la presión venosa portal en cirrosis de etiología enólica y por VHC[12].
Los valores normales del GPVH se encuentran entre 3 a 5 mm Hg, siendo los valores superiores a 5 mm Hg indicativos de HP. En los pacientes con cirrosis hepática de etiología vírica y enólica el GPVH continúa siendo el mejor método para evaluar si existe HP clínicamente significativa (HPCS) que se define cuando es mayor o igual a 10 mm Hg; sin embargo, en pacientes con colangitis biliar primaria al existir un componente presinusoidal de HP no se puede evaluar por este método, dado que se puede infraestimar la prevalencia y severidad de la HP. En pacientes cirróticos de etiología metabólica, aunque el GPVH mayor a 10 está íntimamente asociado a la aparición de signos clínicos adversos, puede existir una proporción de pacientes que pueden tener clínica similar a pesar de no haber alcanzado cifras de 10 mm Hg. En resumen, un GPVH igual o superior a 10 mm Hg en pacientes con cirrosis compensada sin varices esofagogástricas va a predecir su desarrollo, posibilidad de descompensación clínica como ascitis y aumentar el riesgo de desarrollar carcinoma hepatocelular. En pacientes compensados con HPCS, un GPVH por encima de 16 mm Hg predice alta probabilidad de sangrado variceal; y por encima de 20 mm Hg una vez ha sangrado, alta probabilidad de resangrado, fracaso en el tratamiento hemostático y alta tasa de mortalidad[13].
En pacientes con enfermedad hepática crónica y signos clínicos de HP (varices esofagogástricas, ascitis, colaterales portosistémicas) pero con GHVH menor a 10, deben descartarse desórdenes vasculares porto sinusoidales o plantear que no se ha producido una medición adecuada durante la técnica[14]. En la enfermedad hepática crónica relacionada con el alcohol y viral un descenso en el gradiente de PVH en respuesta al uso de betabloqueantes está asociado con una reducción significativa del riesgo de sangrado variceal y otros eventos descompensatorios.
En pacientes con HP prehepática o presinusoidal, en el que la presión en el sinusoide es normal, el GPVH debe ser normal o tan sólo levemente elevada. En pacientes con HP posthepática, sobre todo en aquellos con insuficiencia cardiaca, GPVH será normal porque la presión hepática sinusoidal será igual de elevada que la de la cava inferior como reflejo de la alta presión dinámico (Tabla 6).
Tabla 6
Carasterísticas hemodinámicas según la localización hipertensión portal
Si no es para fines diagnósticos, el uso del GPVH no está ampliamente recomendado en la evaluación de pacientes con cirrosis[15]. Sin embargo, su uso sigue siendo esencial en estudios clínicos de fármacos que investigan una potencial reducción de la presión portal[16].
Endoscopia digestiva alta.
El hallazgo incidental de varices esofagogástricas en una endoscopia digestiva alta establece el diagnóstico de HP y conduce a investigar para determinar la causa de estas, sobre todo, profundizar en el diagnóstico de una posible cirrosis hepática como causa más probable, y si esto fuese negativo, realizar estudios de imagen encaminados a descartar una trombosis venosa portal, que constituye la segunda causa más frecuente de HP. Las varices que se generan serán más grandes en esófago inferior e irán disminuyendo progresivamente de tamaño a medida que asciende el endoscopio; en el caso de que sea al revés, es decir, que el tamaño de las varices es más grande en la porción proximal del esófago debemos pensar en una obstrucción de la vena cava que puede ser secundaria normalmente a tumores o trombosis por cateterismo vascular.
Los pacientes con cirrosis hepática compensada en los que previamente se haya determinado la existencia de HPCS, y no sen candidatos por contraindicación y/o intolerancia a betabloqueantes, deben realizarse una endoscopia digestiva alta para valorar la posible presencia de varices cuando el recuento plaquetario sea inferior a 150 x L ó la rígidez hepática medida mediante elastografía de transición (ET) sea mayor o igual a 20 kilopascales (KPa)[17]. Aquellos pacientes que no se realizan endoscopia pueden ser seguidos anualmente con repetición de ET y recuento de plaquetas[11].
En la última década, un creciente número de estudios han sugerido que la ultrasonografía endoscópica (USE) puede ser útil en la evaluación de la HP. Varices paraesofágicas y la vena gástrica izquierda se pueden visualizar mejor mediante esta técnica, que no sólo se correlaciona con el tamaño de las varices sino que también puede predecir recurrencia de las mismas tras ligadura o escleroterapia[18].
En recientes estudios en modelos animales y humanos, se ha demostrado que se puede conseguir una medición del gradiente de presión portal a través de esta técnica, mediante la punción con una aguja a través del estómago o duodeno para alcanzar la vena porta y después la vena hepática derecha y en ambas localizaciones tomar determinación de la presión venosa. Este método parece seguro y se correlaciona bien con los valores de presión alcanzados por acceso transyugular[19],[20]. Samarasena et al. describen la realización de esta técnica en 28 pacientes, utilizando un ecoendoscopio lineal convencional, una aguja de 25 FNA y un manómetro compacto, con una tasa de éxito técnico del 100% y sin efectos adversos, obteniendo unos resultados que aportaban una excelente correlación con los parámetros clínicos de la HP.
Dada la disponibilidad de la USE en nuestras unidades de endoscopia, la simplicidad de la configuración de la manometría, la medición del GPVH guiado por esta técnica puede representar un avance prometedor para obtener información indispensable en el manejo de los pacientes con enfermedad hepática.
Test no invasivos diagnóstico hipertensión portal
Elastografía de transición (ET).
La introducción de la ET en la práctica clínica ha permitido la precoz identificación de pacientes con enfermedad hepática crónica y el riesgo de desarrollar HPCS, que como consecuencia puede llevar a la descompensación de la enfermedad y aumentar el riesgo de muerte por causa hepática. Se ha notificado en la literatura una buena correlación entre el GPVH y la medición de rigidez hepática en pacientes con fibrosis hepática avanzada[21]. La mejor correlación entre el GPVH y la ET tiene lugar con valores entre 5 y 10-12 mm Hg, rango de HP leve momento en el que está predominantemente aumentada la resistencia intrahepática. A partir de mayores cifras de presión portal la correlación persiste pero va disminuyendo progresivamente puesto que ya comienza a interferir el aumento del flujo venoso hepático[22].
En pacientes con enfermedad hepática compensada de etiología viral, enólica o metabólica (excluyendo a la población obesa), los métodos no invasivos son suficientes para descartar HPCS al definir al grupo de pacientes con riesgo de presentar signos endoscópicos de HP, y que serían aquellos con un resultado de ET mayor o igual a 25 kPa (especificidad y valor predictivo positivo mayor 90%)[21], siempre y cuando, se realicen dos determinaciones en diferentes días cumpliendo los criterios de validez de la técnica acordados por las sociedades científicas. Por el contrario, una ET menor o igual a 15 KPa y plaquetas mayor o igual a 150000 descarta HPCS con una sensibilidad y valor predictivo positivo mayor del 90%. Cuando el resultado es intermedio se puede utilizar un modelo predictivo en el que si valores de ET entre 20-25 KPa y plaquetas menores a 150000 o valores entre 15- 20 KPa y plaquetas menores a 110000 el riesgo de HPCS es de al menos el 60%.
Se recomienda en las últimas conferencias de consenso de HP, si existe un riesgo muy bajo de tener varices y, por tanto, podría ser el grupo seleccionado para evitar la realización de momento de una gastroscopia y/o el inicio de betabloqueante, que estos pacientes anualmente deberían ser reevaluados mediante elastografía y recuento plaquetario[11].
Elastografía del bazo.
A medida que progresa la HP, existe un aumento progresivo del tamaño del bazo no sólo secundario al aumento del flujo de retorno sino a la hiperplasia, angiogénesis y posterior fibrogénesis que aumentará su rigidez. De forma similar al hígado, la rigidez esplénica puede detectarse a través de la ET y se ha estudiado para valorar la presencia de varices y grado de HP en pacientes con cirrosis. Parece especialmente útil en causas prehepáticas y presinusoidales de HP[21].
En la última conferencia de consenso de HP, Baveno VII, recoge ya esta opción diagnóstica como útil en pacientes con enfermedad hepática compensada (VHC no tratados; VHB tratados y no tratados) para descartar o confirma HPCS (ET menor a 21 KPa y mayor a 50 KPa, respectivamente). Aun así se afirma que se necesita para mejor definición de los puntos de corte, más estudios con elastografía y sondas específicas que permitan alcanzar una adecuada validación de la técnica[11].
En resumen, en pacientes con HP que se haya identificado por la presencia de varices, algún evento hemorrágico, esplenomegalia con hiperesplenismo o presencia de colaterales portosistémicas en pruebas imagen, se debe descartar la existencia de una cirrosis hepática subyacente por test clínicos, de imagen, endoscópicos y elastográficos. Si no es el caso, los estudios de imagen deberán descartar la presencia de una trombosis venosa portal; y si también es negativa, la medida del GPVH se puede acompañar de la realización de una biopsia hepática.
Tratamiento de la hipertensión portal
La reducción efectiva de la presión portal va a disminuir la incidencia de complicaciones en los pacientes, teniendo un potencial impacto en la supervivencia. Las opciones terapéuticas actualmente disponibles tienen una eficacia limitada no exenta de riesgos. Se continúa investigando en alternativas terapéuticas en HP más potentes y seguras. El efecto de los fármacos o del intervencionismo sobre la presión portal puede ser evaluado indirectamente mediante resultados clínicos, como puede ser la incidencia de sangrado por varices, o directamente mediante medición del GPVH. Si se logra un gradiente menor a 12 mm Hg o se reduce un 20% del valor basal se ha asociado a un descenso en la incidencia de complicaciones clínicas[23].
Terapia farmacológica
Los bloqueadores beta no selectivos (propranolol, nadolol o carvedilol) son la primera clase de fármacos encontrados para disminuir la presión portal a través de la inhibición de la vasodilatación esplácnica inducida por los receptores B2. Carvedilol, un bloqueador beta no selectivo (BBNS)[24] con actividad anti alfa 1 adrenérgica, promueve una mayor reducción de la presión portal en comparación con otros BBNS a través de un bloque adicional alfa 1 y reducción de las resistencias vasculares intrahepáticas y de colaterales portosistémicas, por lo que se prefiere en los pacientes con cirrosis que tienen datos de HPCS para evitar descompensaciones. Además de su mayor potencia, estudios demuestran su mayor tolerabilidad y un impacto positivo en la supervivencia de estos pacientes.
El estudio PREDESCI es un ensayo clínico, aleatorizado, controlado a doble ciego en el que participaron ocho hospitales españoles incluyendo pacientes con cirrosis compensada e HPCS sin varices de alto riesgo; todos los participantes tenían mediciones de GPVH con evaluación de la respuesta aguda al propranolol intravenoso. Los respondedores fueron asignados al azar a propranolol vía oral (hasta 160 mg dos veces al día) vs placebo; y los no respondedores a carvedilol (menos 25 mg día) vs placebo. El objetivo principal del estudio fue determinar la incidencia de descompensaciones de la cirrosis definida como desarrollo de ascitis, sangrado, encefalopatía hepática o muerte. Así entre enero 2010 y julio de 2013 se evaluaron 631 pacientes de los que finalmente 201 fueron asignados al azar. El objetivo primario del estudio ocurrió en un 16% del grupo de pacientes con betabloqueantes frente a un 27% en el grupo placebo. Se concluyó afirmando que el tratamiento a largo plazo con BBNS podría aumentar la supervivencia libre de descompensación en pacientes con cirrosis compensada e HPCS, principalmente en cuando a la reducción de la incidencia de ascitis.
La activación del sistema renina angiotensina aldosterona (SRAA) juega un importante papel en la hemodinámica del paciente con cirrosis e hipertensión portal. Los bloqueadores de los receptores de angiotensina también se han descubierto para inhibir la contracción de las células hepáticas estrelladas y reducir la presión portal en modelos animales. Varios estudios de pequeño tamaño han estudiado el efecto de estos fármacos en la HP y en la prevención de complicaciones relacionadas, objetivándose una reducción leve de la presión portal, pero con un descenso clínicamente significativo en la presión arterial sistémica y altas tasas de disfunción renal[25],[26]. Por lo tanto, estos fármacos ya sean en monoterapia o combinación con BBNS no se recomiendan en el manejo de la HP.
También se ha observado una reducción transitoria de la presión portal con octreótide , análogo de la somatostatina con potentes efectos vasoconstrictores esplácnicos. Sin embargo, no da como resultado una reducción sostenida de la presión portal y se ha asociado a alta tasa de efectos adversos graves[27].
Diferentes estudios animales han sugerido el papel de derivados del óxido nítrico en el tratamiento de la HP a través de un efecto vasodilatador selectivo en la circulación intrahepática. Sin embargo, su beneficio podría no confirmarse en estudios clínicos con humanos[28]. Por otro lado, simvastatina, inhibidor de la 3-hidroxi-3 metilglutaril-coenzima A reductasa, aumenta la liberación de óxido nítrico en el hígado disminuyendo la resistencia sinusoidal hepática en pacientes con cirrosis e hipertensión porta, sin haberse objetivado efecto preventivo sobre el sangrado por varices[29]. Así la simvastatina podría conferir un beneficio en la supervivencia de pacientes cirróticos en clase Child Pugh A o B; estudios adicionales sería necesarios.
Finalmente, los pacientes con cirrosis y obesidad también pueden beneficiarse de cambios en el estilo de vida (dieta y ejercicio) con la consiguiente pérdida de peso. Un programa intensivo de 16 semanas de dieta y ejercicio físico moderado condujo a la reducción significativa de la presión portal en estos pacientes, independientemente de la etiología de la enfermedad hepática[30].
Derivación portosistémica
Los procedimientos de derivación portosistémica son muy eficaces para reducir la presión portal. Transyugular intrahepatic portosystemic shunt (TIPS) son un procedimiento realizado por un radiólogo intervencionista a través de la vena yugular interna y que consiste en la creación de un shunt intrahepático artificial entre la vena porta y la vena suprahepática. Con la llegada de los TIPS, los procedimientos quirúrgicos derivativos portocava, mesocava y/o esplenorrenales han quedad obsoletos y relegados a casos muy determinados sobre todo de pacientes no cirróticos[31]. Se recomiendan para el manejo de la hemorragia por varices esofagogástricas refractaria o recurrente, ascitis refractaria, hidrotórax hepático. Algunos datos de insuficiente soporten han sugerido beneficio también en los síndromes hepatorrenal y hepatopulmonar[32].
En los pacientes cirróticos, los TIPS (recubiertos de poli-tetra-fluoro-etileno) preventivos en las primeras 72 horas del evento hemorrágico, están indicados en pacientes con sangrado por varices esofagogástricas, con una clasificación de Child Pugh C < 14 y B> 7, con sangrado activo en la endoscopia inicial o GPVH mayor a 20 mmHg en el momento de la hemorragia. En el sangrado refractario variceal, cuando existe un fracaso al tratamiento médico y endoscópico queda claramente indicado el TIPS de rescate[11].
La colocación de un TIPS puede ser futil en pacientes cirróticos con Child Pugh > o igual a 14, o con MELD > igual a 30, a menos que se prevea un trasplante hepático a muy corto plazo.
Una de las consecuencias del TIPS es un aumento del retorno venoso cardiaco lo que conduce a la elevación del volumen diastólico final[33]; por lo que se debería contraindicar en insuficiencia congestiva grave, hipertensión pulmonar y patología valvular tricúspidea. También debería tenerse en consideración si el paciente presenta una encefalopatía hepática recurrente subyacente sin adecuado control médico. La encefalopatía hepática siempre ha sido una de las complicaciones más temidas del TIPS alcanzando incluso tasas del 45% en algunas revisiones publicadas[34], pero la utilización reciente de stent recubiertos ha disminuido de forma significativa la incidencia de esta complicación.
Mas allá de los beneficios de prevención o control de la hemorragia variceal, existen datos que avalan un aumento significativo de la supervivencia libre de trasplante en pacientes cirróticos con ascitis refractaria a los que se le coloca un TIPS, en comparación con las paracentesis de gran volumen[35]. Un reciente estudio multicéntrico, randomizado que no había sido incluido en metaanálisis previos comparando el uso de TIPS recubiertos vs paracentesis de gran volumen, también ha encontrado beneficio en términos de supervivencia significativo con el uso de TIPS (1 año de supervivencia libre de trasplante del 93% frente al 52%)[36].
Mas allá de la terapia farmacológica con betabloqueantes y el uso de TIPS, dentro del tratamiento de la HP, habrá que añadir el manejo específico de otras diferentes situaciones clínicas derivadas de lo mismo como puede ser el manejo de la ascitis, infecciones del líquido ascítico, hiponatremia y/o síndrome hepatorrenal.
A pesar de todos los avances acontecidos en el paradigma terapéutico de la HP, sigue siendo una enfermedad progresiva con una historia natural, que en el caso de su etiología más frecuente que es la cirrosis hepática, si no se consigue eliminar el agente etiológico y se alcanza el punto de inflexión en el que aparecen las complicaciones de la enfermedad, el trasplante hepático continúa siendo el gesto terapéutico curativo en la mayoría de los pacientes con HP severa.

 Descargar número completo
Descargar número completo Download full issue
Download full issue