CITA ESTE TRABAJO
Santamaría Rodríguez GJ.Trombosis portal en la cirrosis hepática. RAPD Online. 2023;46(4):194-210. DOI:10.37352/2023464.4
Introducción y objetivos
La trombosis del sistema venoso esplácnico, en particular de la vena porta (TVP), es un fenómeno progresivamente reconocido en pacientes cirróticos asociado a la hipertensión portal ( HTP ) - a pesar de haberse asociado clásicamente a una condición prohemorrágica-, debido a patología maligna, bien por invasión directa o por compresión; abscesos intraabdominales; alteraciones de la coagulación; discrasias sanguíneas; pancreatitis; esclerosis endoscópica del esófago; como secuela de la cirugía abdominal y derivaciones porto-cava[1]-[3]. Los pacientes con TVP pueden estar asintomáticos o presentar signos o síntomas de la patología primaria subyacente.
El hígado tiene un sistema circulatorio único desarrollado para protegerlo contra la isquemia. En la cirrosis, el sistema venoso portal representa un entorno particularmente proclive a la trombosis, debido a la reducción del flujo sanguíneo como consecuencia de la HTP cuando la velocidad es menor a 15 cm/seg, al medio inflamatorio secundario al daño hepático y, posiblemente, a traslocaciones de enteropatógenos y a sus productos derivados.
Prevalencia, progresión
La TVP es el evento trombótico más común que ocurre en los pacientes cirróticos, próximo a 1/3 de todos los eventos trombóticos del cirrótico, con prevalencia que oscila entre 5-26 % dependiendo de la técnica de imagen empleada en el diagnóstico y las características clínicas de los pacientes en las distintas series publicadas de pacientes candidatos a transplante hepático (TH) que no presentan cirrosis hepática crónica (CHC)[4],[60]. Comparado con la población general, la presencia de cirrosis se asocia con un riesgo relativo de desarrollar TVP no neoplásica de 7,3[5].
La prevalencia se incrementa a medida que aumenta la gravedad de la enfermedad un 1% en pacientes compensados y hasta el 8-25 % en candidatos a TH[6].
La incidencia anual para el desarrollo de TVP en pacientes con cirrosis oscila entre 7.4-19 %[14],[15], 20 % a los 5 años y aprox. 38.7 % a los 8-10 años[7].
El porcentaje aumenta cuando la técnica de imagen usada es mediante TC o RM[7]-[9], aunque en series más amplias de pacientes estas cifras disminuyen[10],[11]. En un estudio prospectivo de 1243 pacientes cirróticos CHILD A/B, la incidencia acumulada de TVP tras 1-5 años fue del 4.6-10-7 % respectivamente[8].
La TVP se asocia a un aumento en la morbimortalidad postTH[12],[13] pudiendo incluso contraindicar el TH; especialmente si el trombo se extiende a la vena mesentérica superior[6],[13]. En resumen, estos datos revelan la presencia de un problema prevalente, con repercusiones clínicas ostensibles y por ende tributario de potencial terapéutico.
Determinación de la presencia o ausencia de cirrosis
Que la TVP curse asintomática es la norma, habitualmente tras diagnóstico casual, al realizar una ecografía semestral de cribado. Aunque en ocasiones, puede tener consecuencias clínicas relevantes dado que se asocia de forma independiente a mayor riesgo de hemorragia por varices, fallo al tratamiento endoscópico de las mismas, y al riesgo de recidiva, junto con el incremento en la mortalidad a las seis semanas (36% pacientes TVP Vs 16% pacientes sin TVP)[37]. De aquí se deduce que identificar la presencia o ausencia de cirrosis es fundamental a la hora de establecer las implicaciones pronósticas y del manejo a largo plazo. La TVP cirrótica puede ser muy obvia por la historia clínica o técnicas de imagen disponibles; aunque la superficie irregular del contorno hepático también puede estar presente en la trombosis de la vena porta no cirrótica (TVPNC)[38].
La presencia de ascitis tampoco es diagnóstica per se, ya que puede aparecer de forma transitoria hasta en un 40% de TVP agudas. La elastografía de transición puede ayudar, pero tiene sus limitaciones , por lo que en ocasiones la biopsia es necesaria[39].
Las características del líquido ascítico indicarían un gradiente de albúmina sero-ascítico >1.1 con proteínas >2,5 gr por lo general si la función sinusoidal está preservada, al contrario que en cirróticos donde el valor total de proteínas es bajo[40],[41].
Diagnóstico
La ecografía (US) es la técnica de imagen inicial de elección para evaluar la permeabilidad de la VP. El uso del dopplerUS mejora la precisión y es imprescindible para valorar la permeabilidad, con una sensibilidad cercana al 90% si la TVP es completa y del 50% si es parcial[4],[16].
El diámetro de la porta normal no debe ser >13 mm y este puede disminuir durante la inspiración y aumentar durante la espiración y la maniobra de Valsalva. En ocasiones se ven ecos de bajo nivel causados por el flujo sanguíneo lento de la VP normal, dichos ecos no deben confundirse con una TVP.
El Doppler muestra flujo hepatópeto casi continuo de baja velocidad que desciende durante la inspiración y aumenta durante la espiración siendo la velocidad normal de flujo aprox. 20-30 cm/seg[17].
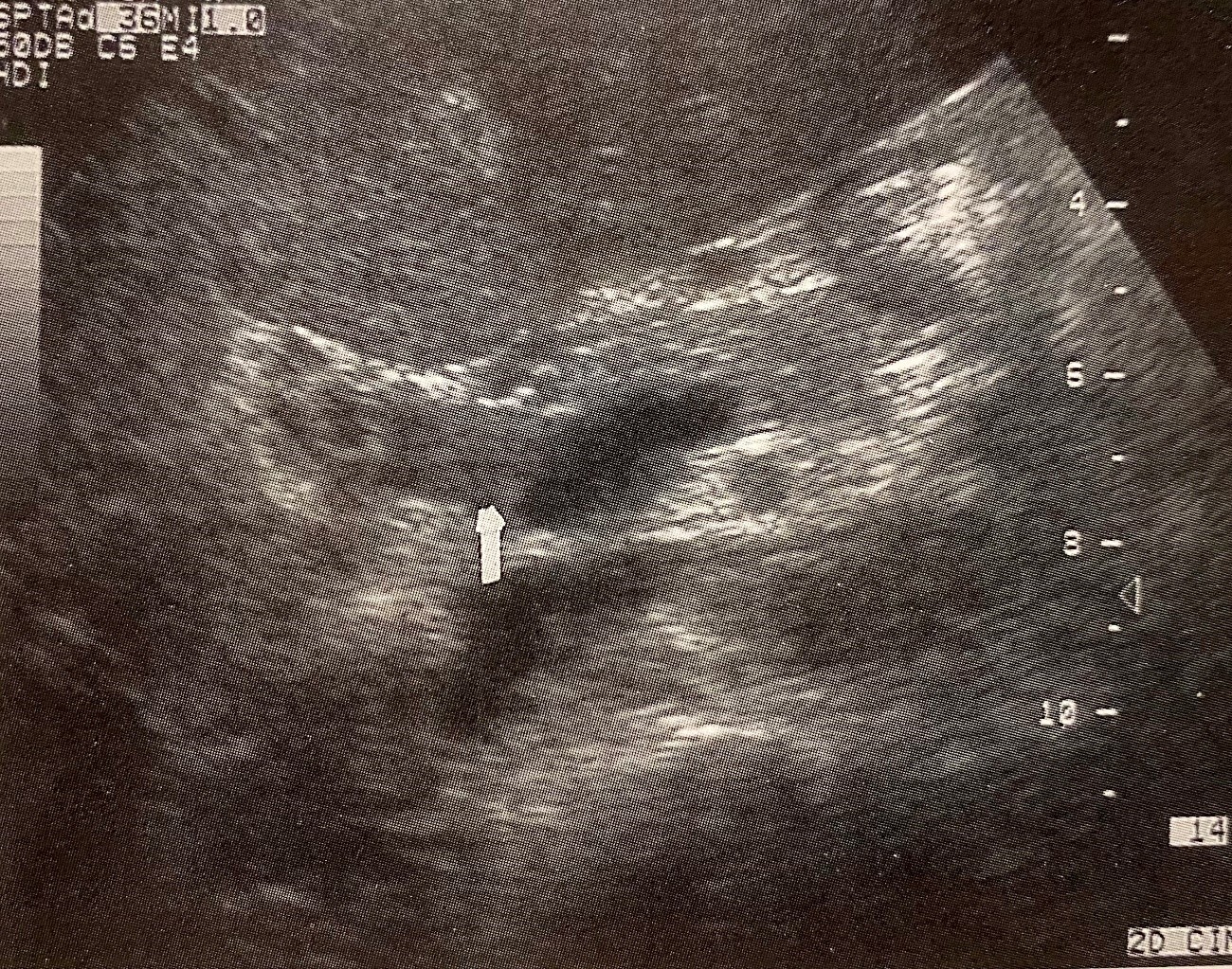
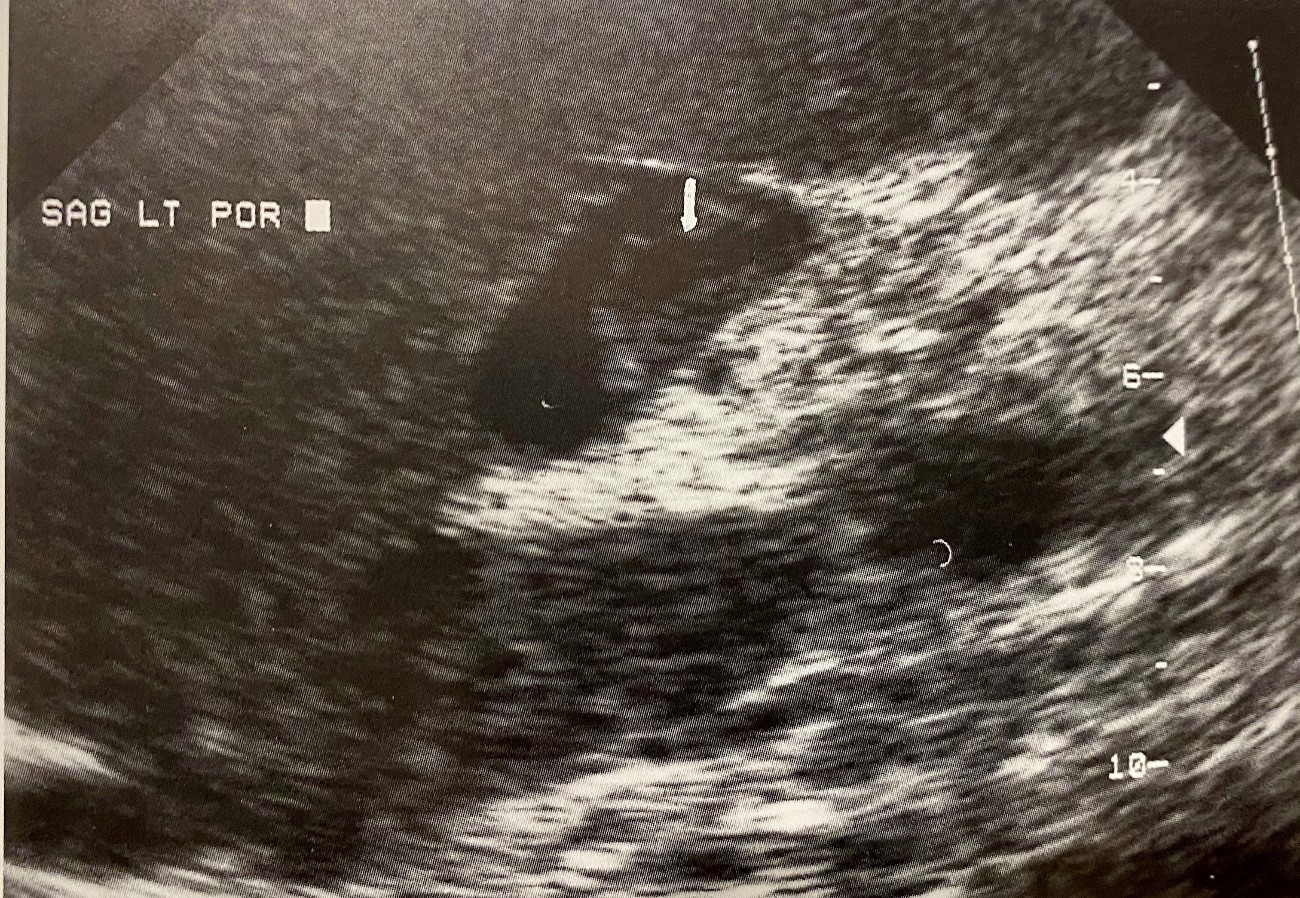
Los trombos agudos pueden ser hipoecogénicos o anecogénicos, resultando entonces difíciles de visualizar por eco en tiempo real. En la trombosis parcial, puede observarse algún flujo sanguíneo como indica el flujo espectral y en la TVP puede asociarse con descenso en el índice de resistencia (<0,5) en la arteria hepática (Figuras 1, 2A y 2B) .
El Doppler US muestra sensibilidad global 89% y especificidad del 92% en comparación con la angiografía o la cirugía[18].
Aunque dependen de la experiencia del observador[19], a veces es difícil distinguir el origen benigno de la TVP, pudiendo registrarse en el caso de malignidad tanto flujo hepatópeto como hepatófugo[20]-[22]. Así mismo, el flujo continuo no es un indicador específico de patología benigna frente a la tumoral, aunque la presencia de señales Doppler de características arteriales en el interior del trombo o arterialización del flujo sugieren malignidad[23].
Por estos motivos suelen ser necesarias técnicas adicionales para confirmar el diagnóstico.
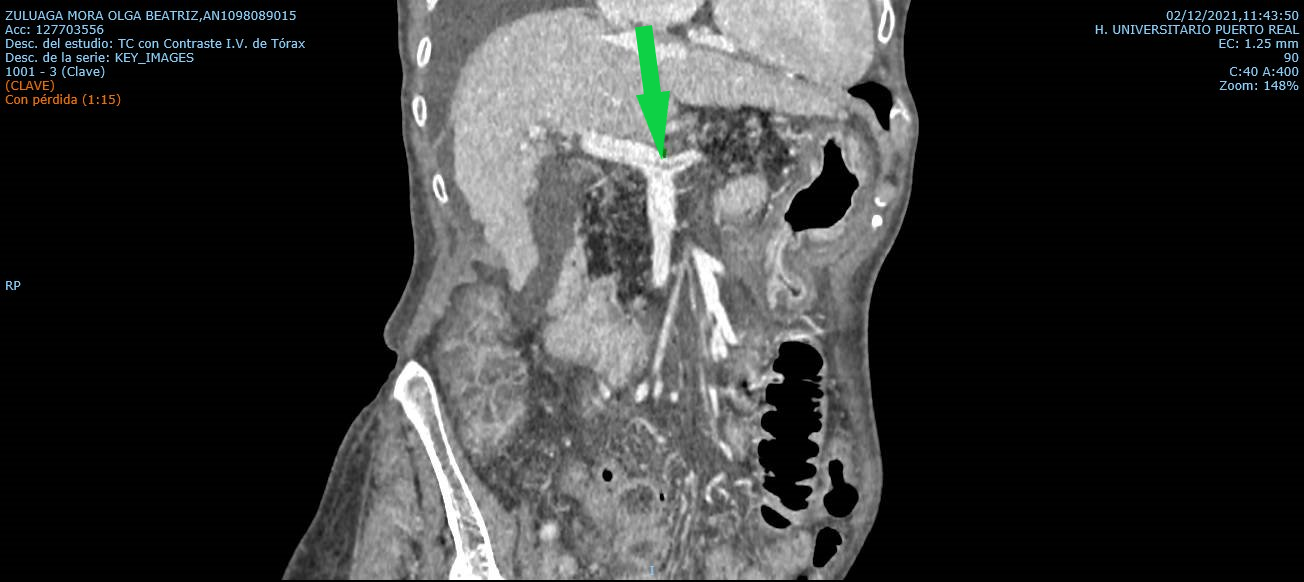
La US con contraste aumenta la tasa de detección de trombosis y permite el diagnóstico de origen tumoral cuando se identifica captación de contraste por el trombo. Igualmente, ocurre en la angiografía por RM y angiografía por TC junto con su aspecto expansivo, permitiendo establecer el origen neoplasico[24].
De igual forma, es de especial relevancia el establecimiento de sí la TVP es de aparición reciente o bien crónica, especialmente en aquellas que cursen silentes, aprovechando para este fin el cribado semestral que se realiza para el despistaje de hepatocarcinoma (CHC) en aquellos pacientes cirróticos o con factores de riesgo asociados, estimándose de nueva aparición si no estaba presente en los controles previos.
En este sentido, la aparición de un cavernoma o transformación cavernomatosa de la VP se produce por trombosis de la VP extrahepática, conduciendo a la formación de colaterales periportales en el hilio hepático alrededor de la VP obstruída con el objeto de mantener el flujo sanguíneo portal hepatópeto hacia el hígado y esplenomegalia[25], todo ello orientando hacia la cronicidad del mismo, así como la presencia de calcificaciones[26]-[27].
También es posible encontrar alteraciones de la arquitectura hepática (zonas de atrofia/hipertrofia) e incluso imágenes nodulares correspondientes a áreas de hiperplasia nodular regenerativa en relación con la alteración de la perfusión hepática[28]-[29].
Tanto el angioTC como la angio RM dinámicas tienen el rol de la confirmación diagnóstica en ausencia de un ecografista experimentado, y ambos son fundamentales para el mapeo de la red de colaterales intra y extrahepáticas y/o para la planificación de futuras medidas terapéuticas en el seno de un equipo multidisciplinar.
Cuando se realiza el diagnóstico de TVP es importante identificar la extensión y el porcentaje de luz que ocupa, en especial para detectar una posible progresión o evaluación de la respuesta a un eventual tratamiento, así como la presencia o no de CHC (Figura 3).
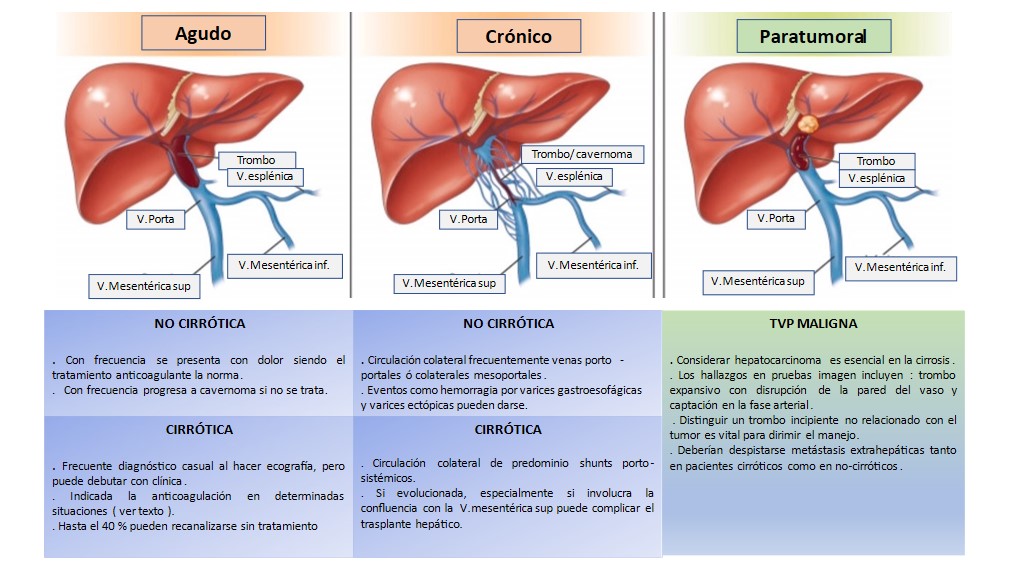
Figura 3
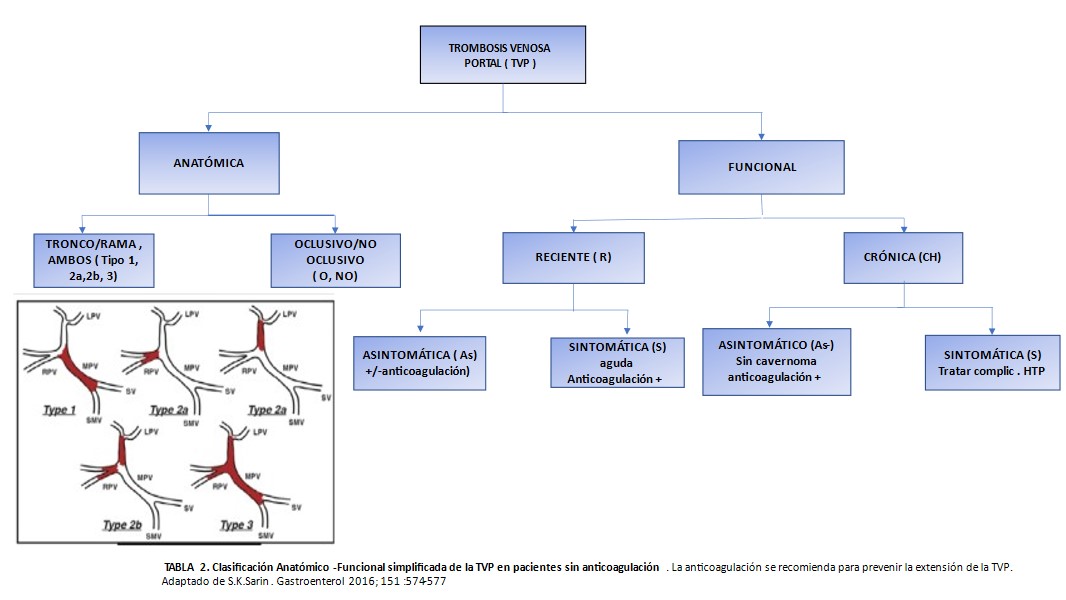
Tipos de trombosis venosa portal (adaptada de Intagliata N, Caldwell H et Tripodi A. Gastroenterology 2019; 156: 1582-1599).
Se han propuesto varios modelos de clasificaciones, siendo la más frecuentemente usada la basada en la localización y extensión de la trombosis propuesta por Yerdel[13]. Pero más recientemente Sarin et al. han propuesto una nueva clasificación[30] que toma en consideración no sólo la localización y extensión, sino el modo de aparición y la cronología al diagnóstico de la trombosis (reciente o crónico); tipo de presentación (signos y síntomas) y la posible afectación hepática subyacente (cirrosis ó hígado sano). El sentido de esta clasificación es servir como punto de partida para definir la comunicación uniforme de la TVP no cirrótica- no maligna, definir mejor los objetivos clínicos y su validación en futuros estudios (Tablas 1 y 2).
Tabla 1
Clasificación anatómico-funcional de la TVP en cirrosis.
La evolución prospectiva de esta clasificación permitiría la estratificación del riesgo para la aplicación de estrategias terapéuticas o preventivas.
Fisiopatología y factores de riesgo asociados a la trombosis portal en cirróticos y no cirróticos
En la cirrosis hepática, la baja presión del fluido por baja resistencia periférica, el flujo lento, así como la circulación hiperdinámica del sistema venoso portal representan un entorno vascular único y propicio. Todas las trombosis venosas son multifactoriales debido a la tríada de Virchow: hipercoagulabilidad, daño endotelial y la reducción del flujo. En cirróticos el desarrollo de TVP se asocia estrechamente a la ralentización del flujo, como hemos visto por la HTP subyacente junto con el desarrollo de shunts portosistémicos espontáneos, a medida que aumenta el gradiente de presión portal el riesgo de trombosis se ve incrementado así como otros factores locales asociados con frecuencia a la cirrosis: infección, cirugía abdominal previa (especialmente tras esplenectomía) y shunts portosistémicos extensos[31].
Los condicionantes para la TVP en pacientes con o sin cirrosis pueden globalmente clasificarse en riesgos de origen local o procesos sistémicos (Tabla 3).
Tabla 3
a) Factores riesgo trombosis portal. Debajo de la tabla: TVP (Trombosis venosa portal), NMPs (Neoplasias mieloproliferativas), QETA (quimioembolización transarterial), TARE (radioembolización transarterial), CHC (carcinoma hepatocelular)a los pacientes cirróticos frecuentemente tienen múltiples FR asociados simultáneamente, estando los riesgos etiológicos en éstos menos definidos. b) Riesgo estimado por estudios prospectivos y guía de la EASL[16]. Los pacientes pueden tener más de un factor riesgo asociado (paciente con un riesgo local puede tener además uno sistémico). Aproximadamente en un 25% no se identifica riesgo causal[28]. El factor de riesgo sistémico más frecuente procoagulante son las NMPs (21%), S antifosfolípido (9%), y las mutaciones gen protrombina G20210A (15%)[28]. Adaptado Intagliata N et al.33 Hernández-Gea V[34].
La decisión de tratar la TVP vendrá determinada por la extensión de la trombosis (parcial o completa) , la presencia de síntomas, la condición de trasplantado del paciente y la cronología del episodio (aguda ó crónica) como veremos[13] (Tabla 2).
Biologia de la hipercoagulabilidad en la trombosis venosa portal
La cirrosis se considera clásicamente un estado prohemorrágico hipocoagulante en función de la presencia de déficit de factores procoagulantes con alteración de las pruebas convencionales de coagulación (INR y tiempo protrombina), junto con la trombopenia. Aunque resulte paradójico, como ya se ha mencionado[32] existe también un déficit en la síntesis de factores anticoagulantes, como la proteína C (PC); proteína S y la antitrombina III y aumento de factores procoagulantes como el factor VIII (FVIII) o el Factor de Von willebrand.
Este delicado equilibrio se volvería precario en determinadas situaciones, y a medida que progresa la enfermedad hepática crónica avanzada, condicionando una tendencia procoagulante[35],[36].
La trombofilia es una condición caracterizada por una hipercoagulabilidad heredada o adquirida secundaria a defectos de la hemostasia que conducen a trombosis venosas, raramente arteriales. Esta condición puede objetivarse tanto en la TVP cirrótica o no cirrótica, aunque por vías diferentes [42],[43].
Mutaciones heredadas como el factor V Leiden y los polimorfismos del gen protrombina G20210A son más frecuentes tanto en cirróticos, como en no cirróticos, siendo esta última la más frecuentemente asociada la TVP en cirróticos [42],[43]. Estas mutaciones son factores procoagulantes relativamente débiles comparado con las deficiencias hereditarias de factores anticoagulantes tales como: antitrombina III, proteína C (P) y proteína S. Entre las adquiridas el síndrome antifosfolípido a la cabeza, mediante la determinación de anticuerpos anticoagulante lúpico, anticardiolipina y/o β2-glicoproteína en al menos en dos determinaciones seriadas separadas al menos 12 semanas según consenso de Sidney[44],[86].
Sin embargo, la expresión fenotípica de la actividad de estos anticoagulantes no puede ser fácilmente medida en la TVP cirrótica ante la precaria capacidad de síntesis hepática ("debido al descenso inespecífico de los factores anticoagulantes, siendo la asociación de éstos un reto diagnóstico"[45]); en estos casos, podría ayudar el estudio familiar, buscando un patrón de herencia). En cualquier caso la homeostasis en la cirrosis tiende a la hipercoagulabilidad debido a niveles disminuidos de PC y elevados de FVIII. La PC activada es el inhibidor fisiológico del FVIII siendo éste el promotor más potente de la generación de trombina. Así, los niveles persistentemente elevados de FVIII (por encima del 150%, no hay que olvidar que es un reactante de fase aguda y se eleva de forma aislada en determinadas situaciones), bajos de PC y el ratio FVIII/PC son un índice de hipercoagulabilidad en la cirrosis con resultados desfavorables[46].
El alcance de estas alteraciones va en consonancia con el grado de insuficiencia hepática más avanzada (Child -Pugh C), la presencia de complicaciones de la HTP, el tratamiento endoscópico previo de las varices esofágicas con esclerosis y la edad son otros factores riesgo asociados al riesgo desarrollo de TVP, como se recoge en el estudio de casos y controles de Tripodi et al.[45],[46] donde se comparan los factores pro y anticoagulantes en sujetos sanos y cirróticos estratificados por Child-Pugh, comprobándose que el desbalance que concurría a un estado hiper o hipocoagulante se incrementaba a Mayor puntaje en el Child-Pugh[47].
Existen hallazgos compartidos entre la TVP cirrótica y no cirrótica más allá de la localización anatómica. Por ejemplo, ambos pacientes responden a la anticoagulación con HBPM, Antagonistas vit K (AVK) ó anticoagulantes orales acción directa (ACODs) en profilaxis primaria[48] o terapéutica con porcentaje éxito fluctuantes entre un 45-82% según las series[49],[50].
Estos patrones de respuesta respaldan la hipótesis de hipercoagulabilidad en ambas formas de TVP no tumoral.
Esto subraya que el auténtico valor de la indagación etiológica de estos factores trombofílicos en pacientes cirróticos con TVP es la capacidad de despistaje del subgrupo de pacientes con un riesgo adicional en los que la anticoagulación será obligatoria de forma indefinida sobre todo en aquellos en lista TH.
Hipercoagulabilidad en TVP no cirrótica
Haremos mención de algunas entidades más prevalentes relacionadas al exceder estas el objeto de esta revisión.
Las neoplasias mieloproliferativas (NMPs) pueden diagnosticarse en sangre periférica y en biopsia de médula ósea, aunque la mayoría de las entidades exigen un aspirado para el diagnóstico. Constituyen siete entidades siendo la Policitemia vera (PV); trombocitemia esencial (TE) y la mielofibrosis primaria las más prevalentes para el riesgo de TVNC, todas favorecen la agregación plaquetaria e incrementan la producción de trombina[34],[70]. Un metanálisis reveló que las NMP están presentes en hasta el 30% de TVPNC y hasta 40% en Budd-Chiari[76],[78].
La presencia de la mutación JAK2v617F (JAK 2) se asocia estrechamente a NMP, estando presente hasta en un 90% PV y 50% en TE, asociándose a trombosis venosa esplácnica[76]. Más recientemente la mutación del gen de la calreticulina (CARL) se ha identificado en el 80% de NMP JAK2 negativa[77], en base a estos hallazgos las mutaciones del JAK2 exón 12 y la del CARL ó receptor de trombopoyetina (MPL) se han convertido en unos de los criterios mayores para el diagnóstico de NMP. Ante un diagnóstico de sospecha de NPMc, en la práctica lo que se determina de forma secuencial, siguiendo las recomendaciones internacionales: ante sospecha trombosis venosa (TV) esplácnica: Estudio de trombofilia "clásico" + Mutación de JAK-2 (1/3 de los pacientes pueden tener las dos). TV esplácnica con anemia: se añade estudio inmunofenotípico de HPN. TV esplácnica + Trombocitosis/esplenomegalia y JAK-2 negativa: Se completa con Calreticulina y MPL. TV esplácnica + Poliglobulia y JAK-2 negativa: Se completa con la determinación exón 12.
Hipercoagulabilidad en TVP cirrótica
Todos los componentes de la tríada de Virchow, incluyendo el flujo reducido, hipercoagulabilidad y el daño endotelial contribuyen al desarrollo de la TVP en la cirrosis.
Sin embargo, los estudios no muestran que sea una estrategia coste-efectiva el estudio genético sistemático de trombofilia en estos pacientes[51]. Únicamente ciertas poblaciones como aquellos con historia familiar de defectos protrombóticos, pacientes con trombosis en múltiples áreas, trombosis recurrentes o cuando interesa conocerla a efectos de decisiones terapéuticas como por ejemplo la duración de anticoagulación.
Mientras que la evaluación de marcadores endoteliales como el F. Von Willebrand (FVW) o micropartículas endoteliales circulantes son prometedores, su utilidad aún es incierta[52], aunque en un estudio reciente el uso conjunto de FVW + PCR adicionalmente al MELD-Na demuestra mejorar la predicción de la mortalidad en lista espera al TH53.
Historia natural de la TVP y tratamiento
La TVP en cirróticos constituye una situación controvertida que está adquiriendo especial relevancia ahora que entendemos que existe un desbalance o como se ha denominado "rebalanceado" en el sistema coagulativo que puede virar a tendencia al sangrado o bien a la trombosis. La TVP en este contexto frecuentemente se detecta de forma incidental mediante ecografía rutinaria, aunque debería sospecharse en cualquier cirrótico descompensado, especialmente aquellos que sufren agravamiento de la ascitis o epigastralgia súbita como debut de una TVP aguda, aunque a menudo curse asintomática. Tras el diagnóstico inicial por ecografía y confirmación por angioTC/RM, se debe confirmar la localización y extensión del mismo.
La resolución espontánea de la TVP se ha descrito hasta en un 40% aproximadamente en no anticoagulados especialmente en TVP parciales, siendo relevante a la hora de tomar decisiones. En un estudio longitudinal de 1.243 cirróticos bien compensados se detectó TVP (101 de 118 parciales, no oclusivas) y tras seguimiento dejaron de objetivarse en un 70%[8], sin embargo, la probabilidad de progresión es más elevada (del 48 hasta el 70%) en un seguimiento a dos años[50],[55]. Esta circunstancia pone de relieve la variabilidad en la progresión espontánea y la heterogeneidad en la regresión en el tiempo de la TVP, por lo que algunos autores proponen realizar técnicas de imagen de seguimiento antes de los tres meses para confirmar persistencia de la permeabilidad previo a consideración terapéutica, a la vez que iniciar TA en aquellos candidatos a TH, sintomáticos, cuando el trombo se extiende a la VMS o historia de trombofilia conocida[54].
Es importante resaltar la distinción entre el efecto de la TVP sobre aquellos evaluados para el trasplante hepático (TH) y el papel que tiene sobre la evolución de los pacientes cirróticos en general. Existe evidencia que apoya el papel de la anticoagulación en pacientes candidatos a TH con vistas a recanalizar la VP previa y preservar el flujo al nuevo injerto. Aunque los datos que sustentan la anticoagulación al margen del contexto del TH son más imprecisos , existe cierta evidencia de que determinados pacientes se beneficiarían de la recanalización de la VP[56] , siendo el inicio precoz de la anticoagulación el factor más importante de recanalización[57], siendo el tiempo medio entre el diagnóstico de TVP y el inicio anticoagulación inferior a 6 meses el que mejor predice la posibilidad de respuesta[50]. La presencia de una TVP incrementa la complejidad quirúrgica y disminuye la supervivencia postTH comparada con pacientes sin TVP[58], aunque los pacientes en lista no parece que tengan mayor riesgo de mortalidad previa al TH.
Tratamiento farmacológico para la TVP cirrótica
Las heparinas de bajo peso molecular (HBPM) y los antagonistas vitamina K (AVK) son los fármacos más ampliamente estudiados en población cirrótica[49],[50],[61]. Entre sus inconvenientes destacan la administración parenteral de las primeras y las dificultades de control y cumplimiento de dieta con los AVK. A pesar de la escasez de estudios amplios que evalúen la eficacia y seguridad en pacientes cirróticos, en los últimos años, debido en parte a las dificultades de los anteriores, se ha desplazado la atención a los anticoagulantes orales de acción directa (ACOD).
La mayoría de estudios en cirróticos con TVP suelen ser retrospectivos y escasos, con definiciones diferentes en los objetivos propuestos; criterios de inclusión y los tiempos de tratamiento, en este sentido se han publicado varios metaanálisis que ponen en evidencia esta heterogeneidad (Tabla 4)[62],[75],[80],[83],[84],[85]. En cualquier caso, existe una clara asociación entre el diagnóstico y la administración del tratamiento precoz (dentro de los 6 primeros meses al diagnóstico) y la tasa de éxito tras el mismo, siendo el factor predictor más importante de recanalización[50],[62] como ya se ha descrito, aunque debe interpretarse en el contexto de las limitaciones referidas, incluyendo la ausencia de estudios prospectivos que mitiguen el factor de confusión de la recanalización espontánea.
Tabla 4
Anticoagulación en pacientes con TVP no tumoral en la cirrosis.
Dos estudios que evaluaron la anticoagulación en pacientes en lista TH revelaron que la anticoagulación es efectiva y segura[12],[75]. El tiempo de anticoagulación es vital y la mayoría de estudios insisten acerca del inicio precoz para mayor probabilidad de recanalización[49],[50].[62] .
En el estudio fundamental de Delgado et al.[49] evaluaron a 55 pacientes con cirrosis +TVP tratados con Heparinas bajo peso molecular ( HBPM ) y / o antago.vitamina K ( AVK ), previo a la anticoagulación, el 75 % tenían TVP parcial y el 60 % consiguió la recanalización parcial o completa (con un 9 % de eventos hemorrágicos). Igualmente, se ha asociado la presencia de ascitis con una menor respuesta a la anticoagulación[63].
Se ha descrito una recurrencia de TVP de hasta el 38 % al suspender la anticoagulación, por lo que se sugiere la prolongación del tratamiento anticoagulante después de la repermeabilización para prevención de la re-trombosis[49],[85].
Anticoagulantes orales de acción directa (ACOD)
El uso de los nuevos ACOD que inhiben de forma directa el receptor de la trombina (dabigatrán) o inhibidores del Factor X activado (apixabán, betrixabán - sin indicación por la EMA por aumento del riesgo hemorrágico-, edoxabán y rivaroxabán), se ha extendido en la práctica clínica por su perfil de seguridad sin necesidad de monitorización por laboratorio (dosis fija), una semivida corta, no interfieren con la ingesta, rápido inicio de acción, bajo riesgo de sangrado y su reversibilidad , aunque solo dabigatrán tiene antídoto el fragmento Ac monoclonal Idarucizumab, el resto anti-Xa tiene Andexanet alfa, de uso solo en hemorragia grave. Actualmente, se consideran el pilar del tratamiento de la FA no valvular y el tromboembolismo venoso, incluyendo a la trombosis venosa esplácnica[64]. A pesar de que los estudios acerca del uso de estos fármacos en TVP en cirróticos compensados están proliferando, aún son escasos[65],[66], las principales agencias reguladoras de fármacos tales como la EMA y FDA permiten el uso de los anticoagulantes orales directos con precaución en aquellos pacientes clase A de Child-Pugh, con restricciones en el resto como veremos en las recomendaciones adoptadas recientemente por el último consenso de BAVENO VII y la SETH (Sociedad Española de Trasplante Hepático y Sociedad Española de Trombosis y Hemostasia)[59],[67].
La hemorragia es la complicación más temida, aunque el riesgo global en la población de pacientes seleccionados parece relativamente baja (Tabla 4 ), aunque la comparación en los estudios es un desafío debido a la ausencia de una definición clara y uniforme de sangrado. Siendo los cirróticos población de alto riesgo de hemorragia, se recomienda implementar adecuada profilaxis de hemorragia variceal con beta-bloqueantes o con ligadura endoscópica de las varices, antes del inicio de anticoagulación en estos pacientes[16],[59].
En un estudio, Cerini F et al. compara la hemorragia alta en pacientes cirróticos anticoagulados (27 % de la cohorte anticoagulada por TVP) con cirróticos no anticoagulados , concluyendo que la anticoagulación no eleva la severidad del sangrado o la mortalidad como consecuencia del mismo[68]. En ensayo randomizado reciente de 80 pacientes cirróticos con TVP tras esplenectomía, se comparó Rivaroxabán 10mg/12 h Vs Warfarina, alcanzándose tasas de recanalización completa del 85% Vs 45% ó parcial (15% Vs 0 %) a favor del ACOD. La tasa de recurrencia tras discontinuar el tratamiento y los eventos hemorrágicos graves solo ocurrieron en los tratados con Warfarina (10% y 42,5% respectivamente)[84] aunque estos resultados deben interpretarse con precaución, debido al tamaño de la muestra de estudio, posibilidad de sesgos de selección y variables de confusión.
Papel del tips (derivación portosistémica transyugular)
El TIPS constituye una terapia efectiva para disminuir hipertensión portal y recanalizar la VP con permeabilidad sostenida[50],[69],[71].
Permite el acceso directo a la VP pudiéndose realizar trombólisis o angioplastia seguida de la instauración del TIPS y restablecimiento del flujo. En pacientes con trombosis avanzadas oclusivas, incluyendo cavernomas, la recanalización VP mediante instauración de TIPS transesplénico es un abordaje relativamente seguro y ha demostrado ser una estrategia eficaz para la recanalizar la VP previa al TH con menos efectos secundarios que el abordaje transparietohepático en manos expertas y en centros de referencia.
En cualquier caso, en la mayoría casos la indicación del TIPS no es la propia TVP sino otras complicaciones derivadas de la HTP. Los factores de riesgo identificados para el fallo del TIPS son la ausencia de identificación de las ramas portales intrahepáticas (o la presencia de trombosis dentro de las mismas) que requiere de abordaje percutáneo incrementando el riesgo de complicaciones durante el procedimiento[72], la presencia de un cavernoma sin poder identificar el tronco de la portal principal y la ausencia de una zona clara de "aterrizaje" en la vertiente esplácnica/territorio mesentérico[73].
En una cohorte de 61 pacientes (56 % con TVP completa), el 98% alcanzó recanalización mediante el TIPS y se mantuvo en el tiempo de seguimiento de 19,2 meses en 55 pacientes, de éstos, 24 se trasplantaron con éxito mediante anastomosis portoportal fisiológica[74].
Aunque cada vez la evidencia es más robusta, cada centro debe definir su propio algoritmo de actuación en base a su propia experiencia, perfil de pacientes, teniendo en consideración como dato primordial la eventual indicación al TH, el grado y extensión de la TVP, la existencia de trombofilia subyacente, historia de trombosis previa, o la presencia de complicaciones de la HTP[16],[59].
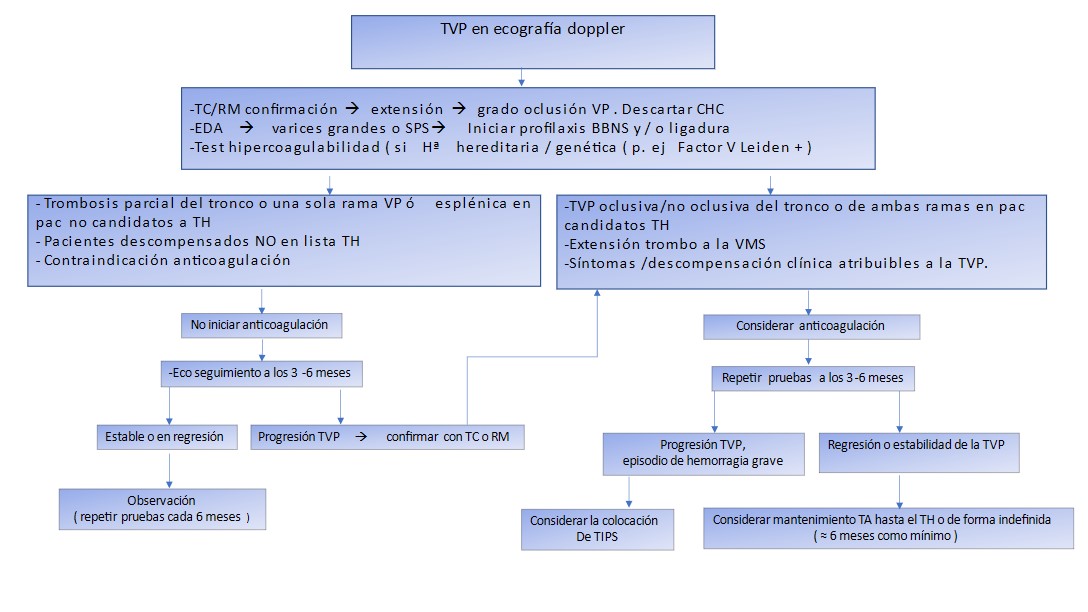
Finalmente, exponemos a continuación algoritmo de manejo propuesto (Figura 4) y las últimas recomendaciones recientes adoptadas de actuación para la trombosis portal cirrótica por Baveno y la SETH, basadas en el sistema GRADE de evaluación[59],[67],[79]: "A" (evidencia alta proveniente ensayos clínicos randomizados), "B" (evidencia moderada de limitación metodológica), "C" (evidencia baja de estudios observacionales/no sistemática ), fuerza de la recomendación 1 ( robusta), 2 ( débil):
Figura 4
Enfoque terapia anticoagulante Debajo figura: FIGURA.4 Enfoque terapia anticoagulante en pacientes cirróticos con TVP considerando riesgo-beneficio. Abrev: TC tomografía computarizada, RM resonancia magnética, EDA endoscopia oral alta, SPS signos premonitorios sangrado, BBNS betabloqueantes no cardioselectivos, TA terapia anticoagulante.
Se debe evaluar la permeabilidad de la VP en todos los pacientes con cirrosis hepática en lista espera TH cada 3 meses, alternando ecodoppler con técnicas radiológicas dinámicas (angioTC/angioRM), así como evaluar la potencial progresión de la trombosis ( 1B).
En caso de CHC y TVP, no implica origen tumoral, requiere de prueba imagen con contraste confirmatoria o biopsia del trombo (1A).
En pacientes con cirrosis y TVP puede considerarse estudio trombofilia ( no de forma universal) si historia familiar o sospecha biológica (1A).
En pacientes con TVP y varices esofágicas que requieran anticoagulación deben recibir profilaxis hemorrágica (con BBNS o ligadura) sin demora. Si precisan puede iniciarse profilaxis y anticoagulación simultáneamente (1 A).
Se recomienda terapia anticoagulante (TA) en todos los pacientes con TVP parcial (>50%) o completa en lista espera TH o potenciales candidatos al mismo, si no existen contraindicaciones, especialmente si extensión a la VMS ó no, progresión de la trombosis, o si es sintomática -independientemente de la extensión- y mantenida hasta el TH independientemente de la resolución del trombo (1 A).
La anticoagulación debe iniciarse con HBPM en 1ª línea (1C). Ajustando la dosis al peso, función renal, cifra plaquetas, no siendo necesario monitorizar los niveles anti-Xa, salvo en embarazadas, pacientes obesos o con insuficiencia renal, valorando riesgo beneficio individual (1 A).
Los AVK pueden considerarse en 2ª línea, pudiendo revertirse su efecto mediante vitamina K o complejo protrombínico ( 1 B).
Con la evidencia actual se aceptan el uso de ACOD en pacientes Child-Pugh A en las indicaciones aprobadas. Apixabán, edoxaban y rivaroxabán contraindicados con FG < 15 ml/min y dabigatrán con FG <30ml/min. Dada la posibilidad de acumulación, el uso de dabigatrán y apixabán debe ser cauteloso en Child-Pugh B, al igual que en pacientes con aclaramiento creatinina < a 30mL/min (rivaroxabán y edoxaban están contraindicados). En Child-Pugh C no se recomienda fuera de estudios controlados (B2).
La indicación del TIPS en pacientes con TVP debe evaluarse mediante equipo multidisciplinar de forma individual, especialmente si no hay recanalización tras TA en aquellos en lista TH (C2). Está contraindicado en Child-Pugh C (1 A). La trombólisis percutánea debe valorarse de igual forma por el equipo individualizando cada caso (1 A).
Conclusiones
A día de hoy, con la evidencia disponible, no existen claros predictores de recanalización espontánea de la TP, futuros estudios prospectivos deberían monitorizar los datos de eventual recanalización para entender mejor la historia natural de la TP y seleccionar con mayor precisión a los pacientes que se beneficiarán del tratamiento.
Generalmente, no existen ensayos prospectivos en estas poblaciones, y con frecuencia los cirróticos son excluidos de los estudios de anticoagulación, especialmente con los nuevos ACOD, por lo que estimar los riesgos / beneficios sigue siendo un reto, quedando su indicación en la TP cirrótica excluida de la ficha técnica, y no estando financiados para esta indicación. Las guías de práctica clínica basadas en opiniones de expertos se decantan a favor de la anticoagulación precoz con HBPM/AVK siendo relativamente segura en la cirrosis Child-Pugh A para el tratamiento de la TVP en aquellos candidatos a TH[16],[59], siempre individualizando la decisión clínica , y con el objetivo de la prevención de la progresión del trombo y la recanalización de la VP al momento del TH para permitir la anastomosis porto-portal termino-terminal.
Aunque consideramos que se requieren de más ensayos prospectivos en la que se incluyan pacientes cirróticos y se determine si requieren ajuste de dosificación, habida cuenta del compromiso en la metabolización hepática y si se beneficiarían de pruebas de laboratorio a efectos de individualización y aumento en la precisión de la TA, especialmente en los nuevos ACOD. De momento, nos guiamos por opiniones de expertos para la toma decisiones clínicas. En cualquier caso, en el momento actual, con todas las consideraciones indicadas, la anticoagulación se postula como abordaje terapéutico primordial de forma precoz y segura, siempre tras una correcta profilaxis de sangrado gastrointestinal, constituyendo una norma con el máximo grado de evidencia[16],[59],[67].

 Descargar número completo
Descargar número completo Download full issue
Download full issue