CITA ESTE TRABAJO
Prieto Torre M, Tejero Jurado R, Rodríguez Perálvarez ML. Opciones terapéuticas en hepatitis aguda alcohólica: ¿Debemos pensar en el trasplante hepático? RAPD 2024;47(1):9-21. DOI: 10.37352/2024471.1
Introducción
El alcohol ha formado parte de la cultura humana durante siglos, siendo actualmente la sustancia psicoactiva más consumida a nivel mundial. A pesar de que se ha constatado un descenso progresivo en su ingesta, actualmente más de 2.3 billones de personas (43% de la población mundial) consumen alcohol[1],[2]. Paradójicamente, la cantidad de alcohol per cápita consumida se ha elevado desde los 5.5 litros en 2005 hasta los 6.4 litros en 2016, y es predecible que esta tendencia continúe al menos hasta 2030[3].
El alcoholismo provoca anualmente alrededor de 3 millones de muertes, siendo la séptima causa de muerte y de pérdida de años de vida ajustados por discapacidad[4],[5]. Las muertes secundarias a enfermedades digestivas son las más numerosas con un 21%; resalta significativamente entre ellas la cirrosis hepática[1].
El consumo continuado de alcohol produce cambios histológicos en el hígado que incluyen esteatosis, inflamación, balonización de hepatocitos, fibrosis y finalmente cirrosis. A nivel clínico, el espectro de las enfermedades hepáticas relacionadas con el alcohol es muy amplio y abarca desde la esteatohepatitis hasta la cirrosis hepática avanzada.
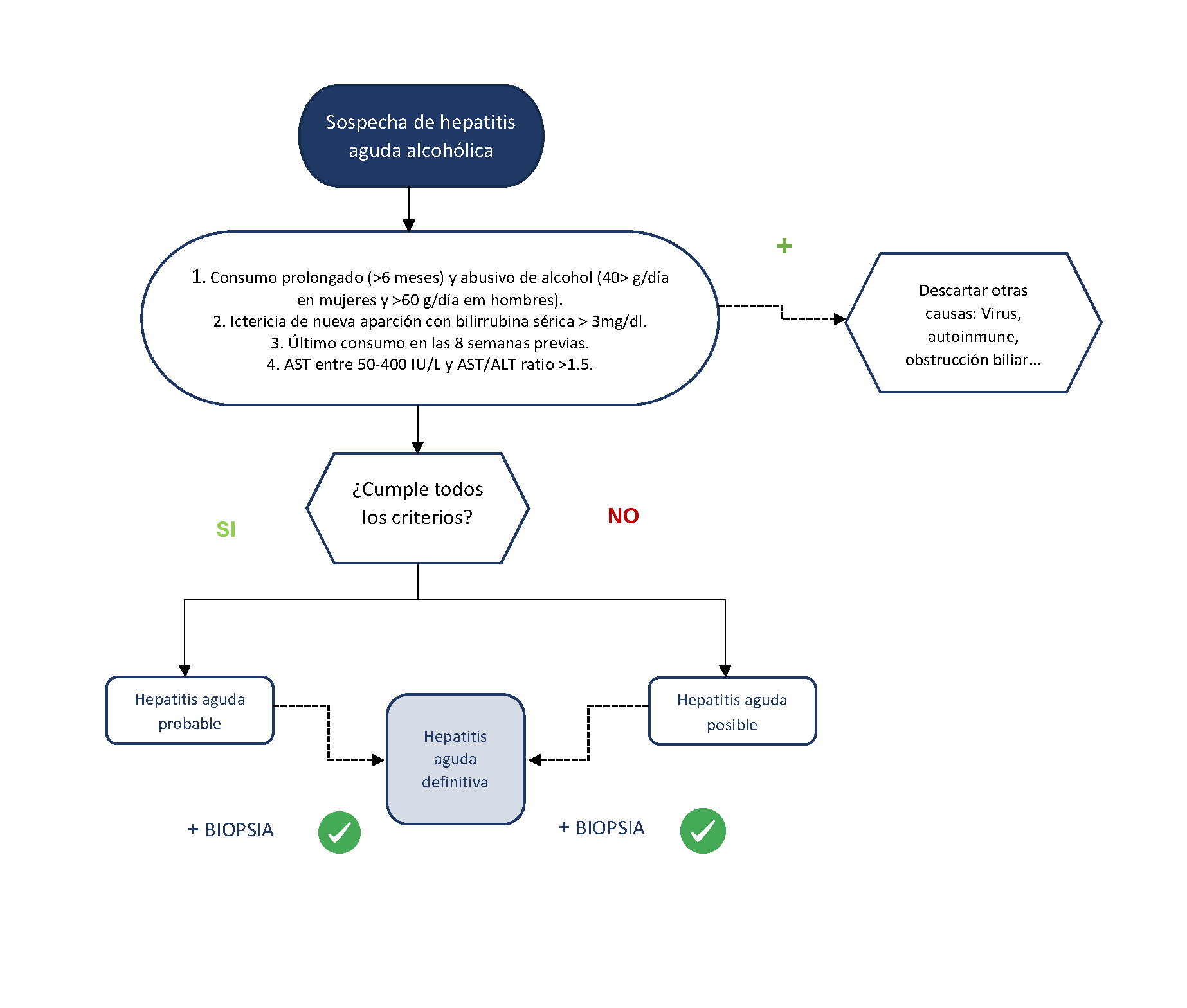
La hepatitis aguda alcohólica (HAA) es una entidad muy particular dentro de la enfermedad hepática por alcohol. Ocurre habitualmente en pacientes con alcoholismo crónico que presentan un aumento del consumo de alcohol en las 4-6 semanas previas al inicio del cuadro. Los pacientes desarrollan una rápida aparición de ictericia, asociada a molestias abdominales inespecíficas, astenia y coagulopatía, con o sin descompensaciones hepáticas tales como ascitis o encefalopatía hepática[6]. En la exploración, es frecuente encontrar estigmas de alcoholismo tales como arañas vasculares, hipertrofia parotídea bilateral, exoftalmos o Dupuytren, así como hepatomegalia dolorosa y/o esplenomegalia. La National Institute on Alcohol Abuse and Alcoholism (NIAAA), publicó en 2016 una propuesta para unificar los criterios diagnósticos de la HAA[7][7]. En este consenso se estimó que la cantidad de alcohol mínima para desarrollar una HAA debe ser al menos de 40 g/día en mujeres y 60 g/día en hombres, aunque a menudo son cantidades muy superiores. Es frecuente que los pacientes tengan una historia de alcoholismo de más de 5 años y es frecuente el abandono del alcohol unos días antes del ingreso, coincidiendo con el inicio de los síntomas. El consumo de alcohol durante más de 6 meses y una abstinencia menor a 60 días son requisitos fundamentales para el diagnóstico. Analíticamente, los pacientes deben presentar cifras de bilirrubina sérica superiores a 3mg/dl y elevación leve-moderada de transaminasas, con una ratio AST/ALT >1.5. Es importante recordar que la HAA es la única hepatitis aguda con transaminasas por debajo de 10 veces el límite superior de la normalidad por lo que tanto AST como ALT deben estar por debajo de 400 UI/L. Por último, se debe realizar un diagnóstico de exclusión en el que es preciso descartar otras patologías como hepatitis virales, enfermedad de Wilson, obstrucción biliar, síndrome de Budd-Chiari o hepatitis autoinmunes, entre otras, mediante la realización de los test analíticos correspondientes y una ecografía abdominal. En un contexto epidemiológico, clínico, analítico y ecográfico como el descrito anteriormente, se puede establecer el diagnóstico de HAA de forma no invasiva. La biopsia hepática quedaría relegada a los casos más dudosos, dada las potenciales complicaciones y las restricciones en la práctica clínica (Figura 1). En caso de precisarla, suele ser necesaria la vía transyugular debido a la presencia de coagulopatía y/o ascitis en la mayoría de los casos.
Varios estudios tanto americanos como europeos afirman que la incidencia de HAA muestra una tendencia al alza en los últimos años. En un estudio danés retrospectivo, los autores reportaron un aumento de la incidencia entre 1990 y 2008 de 37 a 46 casos por millón entre los hombres y de 24 a 34 casos por millón entre las mujeres[8][8],[9]. Este efecto se ha reagudizado durante la pandemia por Coronavirus 2019 (COVID-19)[10]. La mortalidad varía según la presentación clínica, puede llegar a ser del 70% al mes en las formas más severas. Por ende, es esencial una adecuada estratificación de los pacientes para conocer la gravedad y el pronóstico para adoptar un plan terapéutico adecuado.
Existen numerosos índices validados que se obtienen a partir de valores analíticos y permiten identificar los casos de HAA graves al ingreso. Los más usados son: Función Discriminante de Maddrey (IFDm) (>32)[11], el MELD (≥21)[12], el índice ABIC (>6,7)[13] y el índice de Glasgow para la hepatitis alcohólica (GAHS) (>9)[14] (Tabla 1). El índice de Maddrey o función discriminante (IFDm) fue el pionero y actualmente se sigue empleando tanto en la práctica clínica como en ensayos clínicos. Aun así, un estudio multicéntrico reciente con más de 2.500 pacientes en el que se evaluó la precisión de los diferentes índices para predecir la mortalidad a corto plazo en la HAA, se concluyó que el índice MELD podría ser más preciso que el IFDm para predecir mortalidad en este escenario clínico[15]. El pronóstico de estos pacientes dependerá directamente de la gravedad del episodio y especialmente de la respuesta al tratamiento médico.
Tabla 1
Variables de los índices pronósticos más empleados en la hepatitis aguda alcohólica.
La presente revisión tiene como objetivo abordar el tratamiento de la HAA desde un punto de vista práctico y multidisciplinar, incluyendo el tratamiento farmacológico específico, el manejo de la desnutrición y de los estados carenciales, la prevención del síndrome de abstinencia, y trasplante hepático. Con respecto a este último, se especifican los criterios actualmente vigentes en España para considerar el TH en pacientes con HAA grave.
Tratamiento Farmacológico
La abstinencia completa es el pilar básico para pacientes con HAA independientemente de la gravedad del cuadro. Continuar con el consumo etílico supone un mayor riesgo tanto de hemorragia digestiva alta varicosa, ascitis, encefalopatía como de muerte[16]. Además, es importante llevar a cabo un abordaje global de estos pacientes, poniendo especialmente atención al manejo nutricional, déficits vitamínicos, así como el tratamiento de las posibles descompensaciones (ascitis, encefalopatía hepática…).
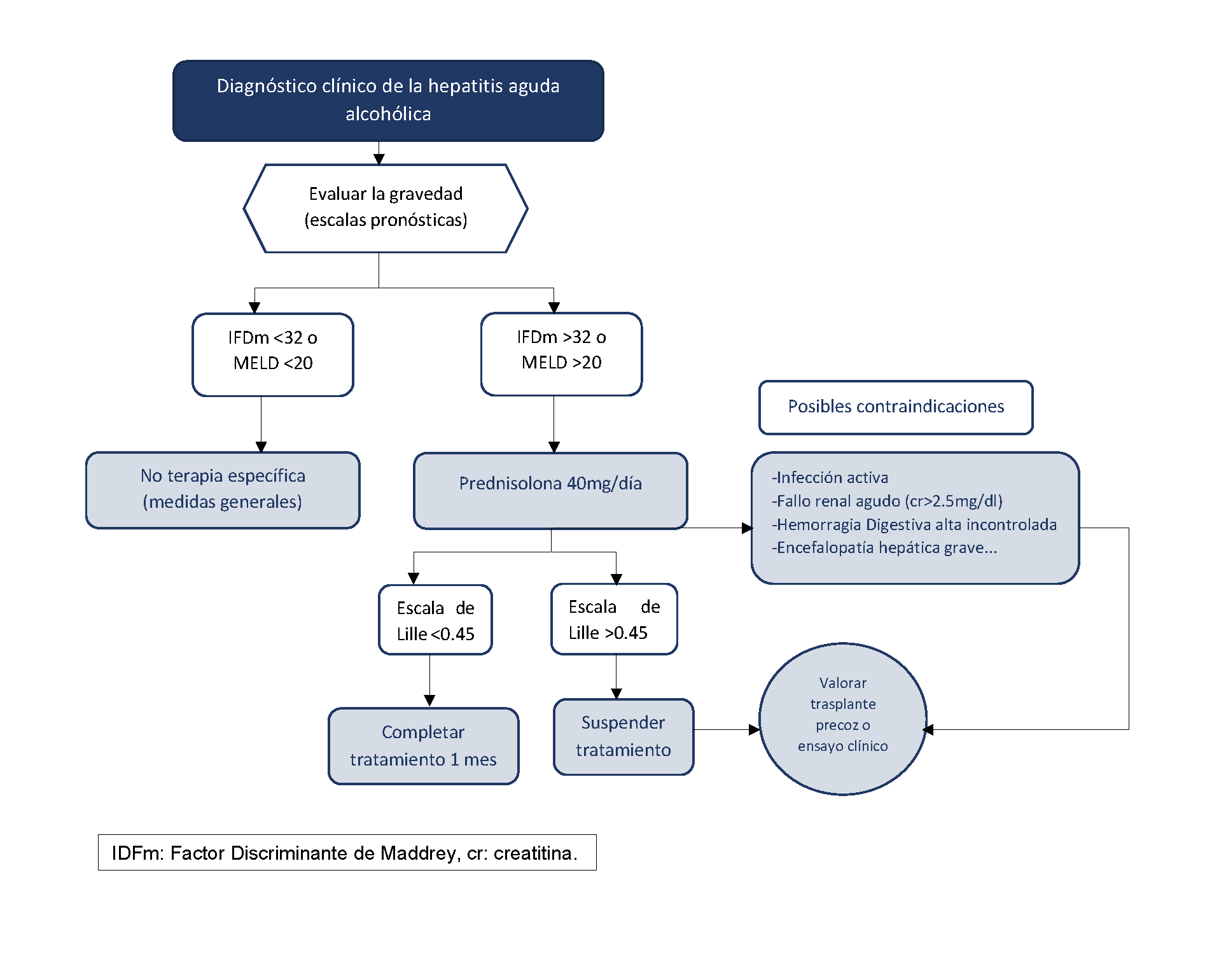
La prednisolona a dosis de 40 mg/día durante 28 días es la primera línea de tratamiento recomendada en todas las guías de práctica clínica para la HAA grave. Aun así, su uso ha sido controvertido debido a la falta de consistencia en los resultados de los estudios que la avalan[17],[18]. Con el fin de solucionar esta polémica, entre 2011 y 2014 se llevó a cabo en Reino Unido un ensayo clínico multicéntrico con 1.103 pacientes. En este estudio se concluyó que los corticoides mejoraban la supervivencia a los 28 días en comparación con la pentoxifilina, pero sin mantenerse dicho beneficio a los 6 y 12 meses de seguimiento[19]. Dado su limitado beneficio y sus potenciales efectos secundarios, la cohorte de pacientes que reciban este tratamiento debe seleccionarse adecuadamente. Los pacientes deben presentar una HAA grave, definida por un IFDm de >32[11] y un MELD de ≥21 aunque el beneficio parece ser más pronunciado en pacientes con un MELD entre 25 y 39[20]. Además, existen algunas contraindicaciones relativas que deben ser evaluadas antes de empezar la terapia como la sepsis, fallo renal agudo grave, hemorragia digestiva alta… Una vez iniciados los corticoides es importante determinar aquellos pacientes no respondedores con el fin de suspenderlos de manera precoz. La escala de Lille es una escala dinámica basada en la evolución de los niveles de bilirrubina en la primera semana (día 1 y 7) que predice el riesgo de fallecimiento. El score de Lille dicta una norma de futilidad del tratamiento corticoideo para aquellos pacientes con puntuación superior a 0.45 en el día +7, en los cuales por tanto habría que suspenderlo[21] (Figura 2).
La pentoxifilina (400mg cada 8 horas v.o.) es un inhibidor de la fosfodiesterasa que se ha empleado históricamente en el tratamiento de la HAA debido a los resultados arrojados en el ensayo clínico de Akrividiadis et al.[22], que demostró una disminución de la mortalidad hospitalaria y de la incidencia de síndrome hepatorrenal. Estudios posteriores no han logrado respaldar dichos resultados. Dos ensayos franceses no pudieron demostrar el beneficio de la pentoxifilina en términos de supervivencia, bien en combinación con el tratamiento corticoides o como alternativa en los pacientes no respondedores a estos[23],[24]. De igual manera el estudio STOPAH y varios metaanálisis no han logrado encontrar ningún beneficio con este fármaco[19],[25],[26]. Es por esto que actualmente, no existe evidencia suficiente para recomendar el uso de pentoxifilina en pacientes con HAA grave, aunque su uso sigue siendo frecuente.
La N-acetilcisteína (NAC) se ha propuesto como una terapia prometedora dado su efecto antioxidante. Ha sido estudiada en múltiples estudios de pequeño tamaño tanto de forma individual como combinada con otros agentes antioxidantes, sin poder confirmar una mejoría en la supervivencia en comparación con el tratamiento estándar[27],[28]. En el estudio multicéntrico publicado en 2011 por Nguyen-Khac, E et al.[29], se estudió los efectos del tratamiento combinado de prednisolona y NAC en comparación con prednisolona y placebo. Se comprobó que la mortalidad al mes de tratamiento era significativamente menor en el brazo de corticoides con NAC, con una reducción en la tasa de infecciones y de síndrome hepatorrenal. Por tanto, aunque la combinación de NAC y prednisolona parece ser un tratamiento prometedor, su uso sistemático en la HAA requiere evidencia de más calidad. Se administra de manera intravenosa con la siguiente posología: en el día 1 a dosis de 150, 50 y 100 mg/ Kg de peso en 250, 500 y 1000 ml de S. glucosado al 5% en periodos de 30 min, 4 horas y 16 horas respectivamente y en los días 2-5 a dosis de 100 mg/Kg de peso en 1000ml de S. Glucosado al 5% por día.
En los últimos años, ha aumentado notablemente el número de ensayos clínicos que investigan nuevas líneas de tratamiento basada en la fisiopatología de la HAA. La mayoría de las terapias van dirigidas a promover una regeneración hepática efectiva, controlar la inflamación hepática[30]-[33], reducir el estrés oxidativo, o renovar la disbiosis intestinal.
El factor estimulante de colonias de granulocitos (G-CSF) (5 μg/kg s.c. cada 12h durante 5 días) actúa movilizando las células madre hematopoyéticas e induciendo la regeneración hepática. En un estudio prospectivo aleatorizado doble ciego que comparaba la terapia estándar con y sin el G-CSF, se reportó una mejoría de la supervivencia a los 3 y 6 meses, así como una reducción de la tasa de infecciones[34]. Sin embargo, un estudio europeo reciente, no ha podido demostrar dicho beneficio[35]. Asimismo, la interleucina-22 (IL-22) en un estudio piloto actual, ha demostrado una alta tasa de mejoría clínica en paciente con HAA moderada-grave con disminución en los marcadores de inflamación y aumento en los marcadores de regeneración hepática[36].
Aunque el factor de necrosis tumoral (TNF) es un importante mediador de inflamación, los ensayos piloto con agentes anti-TNF (infliximab y etanercept) se suspendieron de manera prematura debido a un aumento de la mortalidad por sepsis en el brazo de tratamiento[37]. De igual manera, otras moléculas antinflamatorias como anakinra (anti IL-1) no han demostrado mayor beneficio que los corticoides en pacientes con HAA grave[38]. Sin embargo, actualmente se están llevando a cabo nuevos ensayos clínicos con otras terapias antinflamatorias, como canakinumab[39] y DUR-928[40], con resultados prometedores.
La metadoxina destaca entre los fármacos antioxidantes en estudio. Ha demostrado mejorar las tasas de supervivencia a los 3 y 6 meses en los pacientes tratados con prednisolona y metadoxina vs los tratados únicamente con el corticoide[41].
La disbiosis inducida por el alcohol se asocia con un aumento de la permeabilidad intestinal y de la translocación bacteriana, ambos factores críticos para el desarrollo y progresión de la HAA. Por tanto, las terapias enfocadas a la actuación sobre la microbiota presentan otra atractiva línea de investigación donde se incluye el trasplante fecal, el uso de probióticos y de antibióticos orales no absorbibles.
Manejo nutricional
La desnutrición afecta de forma sistemática a los pacientes con enfermedad hepática avanzada, identificándose las mayores tasas de prevalencia y las formas más graves en la enfermedad hepática por alcohol[42][42]. Dicho déficit nutricional está generado por la disfunción hepática y la presencia de un estado hipermetabólico asociado a una disminución de la ingesta oral y de la absorción intestinal de nutrientes. Específicamente, en la HAA la prevalencia de desnutrición llega a ser casi el 100% incluso en los estadios más precoces[43],[44]. Estos datos son inquietantes ya que la malnutrición supone un factor de riesgo independiente de mortalidad e infecciones locales/sistémicas[45]-[47].
La evaluación del estado nutricional del paciente con HAA en los primeros días del ingreso es un aspecto fundamental para poder proporcionar un aporte nutricional individualizado. La Sociedad Europea de Nutrición Clínica y Metabolismo (ESPEN) recomienda el uso de la valoración global subjetiva (VGS) y evaluación antropométrica para identificar a los pacientes en riesgo, y la bioimpedancia para cuantificar el grado de desnutrición[48]. La VGS es una herramienta sencilla que nos permite obtener información acerca del estado nutricional del paciente con la anamnesis (ingesta dietética habitual, los síntomas gastrointestinales…) y el examen físico (presencia de edema, ascitis…)[49]. Debido a la fisiopatología de la enfermedad hepática, los métodos clásicos como el Índice de Masa Corporal (IMC), la medición del pliegue tricipital o el cálculo de valores bioquímicos clásicos (albúmina, prealbúmina...) no son métodos adecuados para evaluar el estado nutricional de estos pacientes. Se ha propuesto como método óptimo la medición de la fuerza con un dinamómetro de mano el cual es rápido y sencillo. Además, se ha correlacionado con otros marcadores de desnutrición en la enfermedad hepática y es un indicador del estado funcional. Por último, la bioimpedancia se usa habitualmente para el estudio de la composición corporal y se recomienda en pacientes con hepatopatía a pesar de sus posibles limitaciones en la descompensación hidrópica.
Las guías de práctica clínica actuales recomiendan una ingesta media de proteínas de 1,2-1,5 g/kg por día y una ingesta calórica de 30-40 kcal/kg por día en pacientes con HAA[50],[51]. Curiosamente, se ha demostrado que un régimen de nutrición enteral intensivo a través de una sonda nasogástrica no tiene beneficio en comparación con la nutrición oral, además puede presentar efectos secundarios graves especialmente en pacientes con encefalopatía hepática[52].
Aparte de la malnutrición proteico-calórica, existen deficiencias de micronutrientes (vitaminas y minerales) aunque hay poca evidencia acerca del posible beneficio de su suplementación. El déficit de zinc es común en los pacientes con EHA. Algunos estudios[53],[54] han destacado su papel en el mantenimiento de la barrera intestinal y de los mecanismos intracelulares que protegen a los hepatocitos de lesiones mediadas por el alcohol. Estos potenciales beneficios unidos a los mínimos efectos secundarios hacen que su suplementación se recomiende de forma general en el tratamiento de la HAA. Es habitual encontrar déficits de Vitamina A, E, B12, D y magnesio, aunque no existe suficiente evidencia que abale su suplementación en la HAA[55].
Prevención del síndrome de abstinencia
Aproximadamente el 50% de los pacientes con consumo excesivo de alcohol desarrollan algún grado de síndrome de abstinencia alcohólica (SAA) tras un cese abrupto o reducción de ingesta de alcohol[56]. La presentación del SAA varía desde síntomas leves como irritabilidad, taquicardia, hipertensión arterial, hiperreflexia, ansiedad, dolor de cabeza, náuseas y temblores hasta formas graves con convulsiones, alucinosis alcohólica, delirium tremens (caracterizado por cambios del estado mental e intensa hiperactividad autonómica), coma y parada cardiorrespiratoria[57].
Según una revisión sistemática reciente, entre los pacientes hospitalizados por cualquier condición médica con antecedentes de trastorno por consumo de alcohol, un 2-7% desarrollarán un SAA grave[58]. No obstante, la incidencia y el impacto clínico del SAA en pacientes con enfermedad hepática son desconocidos[59]. En el caso de la HAA, la elevada cantidad de alcohol y el consumo prolongado, junto con la necesidad de hospitalización, sitúan al paciente en un alto riesgo de padecer SAA. Un estudio multicéntrico reciente que evaluó la prevalencia e impacto clínico del SAA en los pacientes con HAA concluyó que el SAA se presenta hasta en un tercio de los pacientes ingresados por HAA. Además, se demostró que los pacientes que desarrollan SAA tienen mayor riesgo de encefalopatía hepática, infección y necesidad de ventilación mecánica. Además, en dicho estudio, el SAA aumentó de manera independiente la mortalidad a corto y largo plazo de la HAA y el empleo de sedantes a dosis altas por vía intravenosa para controlar el SAA también se asoció con peores resultados[60].
Aunque las guías de práctica clínica para el manejo de HAA incluyen algunos comentarios sobre el manejo del SAA, hay poca evidencia que respalde el uso sistemático de tratamiento farmacológico profiláctico sea seguro o eficaz. Por ello, hay gran variabilidad en cuanto al manejo[61]. La mayoría de los centros europeos optan por la profilaxis del SAA en pacientes de alto riesgo, incluyendo pacientes con HAA, mientras que esta práctica es muy poco común en los Estados Unidos[62].
La identificación temprana del SAA es crucial para su correcto abordaje. Las escalas de gravedad para el SAA pueden ser útiles, aunque no están validadas en pacientes con HAA. Un ejemplo es la Escala de Evaluación del Síndrome de Abstinencia Alcohólica (CIWA-Ar) donde una puntuación > 8 indica un SAA moderado y una puntuación ≥ 15 indica un SAA grave (tabla 2)[63]. Se recomienda aplicar un tratamiento farmacológico para el SAA moderado y grave basado en síntomas en lugar de establecer dosis fijas, con el objetivo de prevenir el acúmulo del fármaco[64].
Tabla 2
Escala CIWA-Ar. Evaluación del SAA.
Las benzodiacepinas se consideran el patrón oro en el tratamiento del SAA debido a su eficacia para reducir los síntomas de abstinencia, el riesgo de convulsiones y el delirium tremens[65]. Las benzodiacepinas de acción prolongada (por ejemplo, diazepam) proporcionan una mayor protección frente a convulsiones y delirium, pero las benzodiacepinas de acción corta e intermedia (por ejemplo, lorazepam, oxazepam) son más seguras en pacientes ancianos y en insuficiencia hepática[66]. En Europa está muy extendido el uso de clometiazol, un derivado de la tiamina con capacidad hipnótica y sedante. Tanto benzodiacepinas como clometiazol tienen un riesgo potencial de abuso, el cual es mayor el riesgo en pacientes con trastorno por consumo de alcohol. Por ello, se debe evitar el uso de estos medicamentos más allá de 10-14 días y se debe optar siempre que sea posible por benzodiacepinas de vida media intermedia como el lorazepam. Otros medicamentos como el baclofeno y el oxibato de sodio se han aprobado para el tratamiento del SAA, con el valor adicional de que están indicados además para la prevención de recaídas en el consumo alcohólico[67].La seguridad de las terapias actuales no ha sido validada en pacientes con insuficiencia hepática grave o aguda, como ocurre en la HAA[68].
Trasplante hepático
Clásicamente, se ha impuesto un mínimo de 6 meses de abstinencia etílica completa para poder considerar la opción de TH. Este hecho, junto al desconocimiento sobre el pronóstico, los problemas de manejo en la lista de espera y el impacto social negativo que representan en ocasiones, ha excluido hasta hace pocos años a los pacientes con HAA grave de ser candidatos potenciales a trasplante. Sin embargo, la norma de los "6 meses de abstinencia" no ha demostrado predecir el riesgo de recidiva del consumo etílico tras el trasplante hepático[69]. En 2011, el grupo Franco-Belga publicó el estudio observacional casos-controles incluyendo un protocolo de trasplante hepático precoz para pacientes con un primer episodio de HAA grave sin respuesta a tratamiento con corticoides[70]. Los pacientes fueron considerados como candidatos a trasplante si cumplían los siguientes criterios: soporte familiar sólido, ausencia de comorbilidad psiquiátrica y compromiso de paciente y familiares en la abstinencia etílica completa indefinida. Bajo estas premisas, el porcentaje de trasplantes por HAA grave con respecto al total de trasplantes realizados en el mismo periodo fue del 2,9%. Se observó un beneficio muy significativo en términos de supervivencia a 6 meses en el grupo sometido a TH con respecto a los controles (77% vs 23%; p<0,001). Hubo 3 casos (11,5%) de recidiva del consumo etílico a más largo plazo pero ningún paciente desarrolló fallo del injerto por lo que los autores concluyeron que el impacto de la recidiva etílica es limitado. Tras esta experiencia inicial, han seguido varios estudios observacionales retrospectivos que han reproducido los resultados iniciales del grupo Franco-Belga[71]-[74]. La tasa de recidiva etílica post-trasplante en estos estudios oscila entre el 15% y el 20%, lo cual se asocia además a mayor riesgo de cáncer y de pérdida del injerto. En el estudio más numeroso hasta la fecha, un trabajo multicéntrico norteamericano incluyendo 147 pacientes con HAA que accedieron precozmente al trasplante hepático, la tasa de recidiva etílica fue del 17% y en un paciente la muerte se produjo por una intoxicación etílica aguda[73]. Por tanto, aunque el TH ofrece un beneficio de supervivencia muy pronunciado para pacientes con HAA que no responden a corticoides, mayor incluso que en otras indicaciones aceptadas de trasplante, la recidiva etílica es un problema prevalente y de relevancia clínica que requiere la aplicación de medidas de selección de candidatos muy estrictas, a la vez que se adapta la estrategia de seguimiento post-trasplante.
En este contexto, la Sociedad Española de Trasplante Hepático (SETH) se propuso ampliar los criterios de trasplante hepático en el año 2020, tras unos años de acortamiento progresivo de las listas de espera de trasplante debido a la generalización de los tratamientos de la hepatitis C y al aumento del pool de donantes en relación a la donación en asistolia. Entre las posibles áreas de expansión de criterios de trasplante se decidió incorporar la HAA como indicación formal de trasplante hepático[75]. En la tabla 3 se resumen los requisitos para poder considerar el TH en un paciente con HAA. Para que un paciente con HAA grave pueda considerarse como posible candidato a trasplante, debe tratarse de un primer episodio de HAA en el que el paciente desconociese que tenía cirrosis previamente. Si el paciente tenía conocimiento de diagnóstico previo de cirrosis o si había presentado un episodio de HAA en el pasado y a pesar de ello no ha sido capaz de mantener una abstinencia etílica estable, el paciente no debe ser considerado como un candidato adecuado para trasplante debido al alto riesgo de recidiva etílica. El segundo requisito es que se trata de una HAA grave, definida como puntuación de IFDm> 32 o MELD ≥ 21, y que no responda a corticoides (puntuación del modelo de Lille ≥ 0,45 en el día +7). Además, se debe realizar una evaluación de trasplante en la que no se demuestren contraindicaciones para el mismo.
Tabla 3
Requisitos necesarios para considerar la opción de trasplante hepático en pacientes con hepatitis aguda alcohólica en España. Las recomendaciones que se presentan han sido adaptadas del documento de consenso sobre criterios de ampliación de las indicaciones de trasplante realizado por la Sociedad Española de Trasplante Hepático (SETH).
En este escenario, cobra especial importancia la evaluación multidisciplinar en la que es imprescindible una valoración psicosocial para predecir el riesgo de recaída de consumo de alcohol, que es la principal limitación para la inclusión de estos pacientes en los programas de trasplante. Así mismo, en la evaluación pretrasplante de estos pacientes, hay que prestar especial atención a la exclusión de infecciones latentes y malignidad. Sería prudente una suspensión rápida de corticoides en caso de no respondedores según el índice de Lille que sean potenciales candidatos a trasplante hepático, puesto que en el estudio ACCELERATE-AH los corticoides previos al trasplante hepático se asociaron con mayor mortalidad en el postrasplante inmediato, fundamentalmente por causa infecciosa[73].
Un aspecto clave en estos pacientes es asegurar una abstinencia duradera después del trasplante, la cual está influida por factores como la conciencia de enfermedad, existencia de comorbilidades psiquiátricas o de otras adicciones, cantidad de bebidas por día, existencia de intentos repetidos de deshabituación y del apoyo sociofamiliar[76]. Se ha identificado asociación en diferentes cohortes de una edad más joven como un posible predictor de consumo de alcohol postrasplante. Es importante la evaluación minuciosa e integral de todos estos factores por un equipo multidisciplinar que incluya especialistas en adicciones y psiquiatras[77].La aplicabilidad del trasplante debe de ser establecida en base al grado de dependencia alcohólica, así como la existencia de factores favorables para una abstinencia duradera[78].
Existen diferentes instrumentos pronósticos estandarizados que combinan algunos de estos parámetros en una escala de riesgo, pero no están diseñados para pacientes con HAA sometidos a TH precoz y ninguno de ellos cuenta con validación externa sólida[79]-[81]. El score SALT ("Sustained Alcohol use post-LT") es hasta ahora el único diseñado en pacientes con HAA y un periodo de abstinencia etílica pre-TH menor a 6 meses[82]. Evalúa 4 parámetros con una puntuación específica para cada uno de ellos y un score final que oscila entre 0 y 11 puntos (Tabla 4). Se trata de un sistema simple y con una aceptable capacidad para predecir la recidiva grave del alcoholismo post-TH (AUROC 0,76). Una puntuación SALT < 5 obtuvo un valor predictivo negativo del 95% mientras que una puntuación SALT≥5 arrojó un valor predictivo positivo del 25%, la cual sería una tasa inaceptable en el contexto del TH. En otras palabras, siguiendo este sistema, la prevalencia de etilismo grave post-TH en la población sería del 5%. La validación interna en el estudio indicó una buena consistencia del modelo pero aún carece de validación externa[79]-[82].
Tabla 4
Escala SALT. Instrumentos de pronóstico para predecir recaída alcohólica después de trasplante hepático.
Tras el trasplante hepático, el abordaje multidisciplinar con la participación de diferentes especialistas como hepatólogos, especialistas en adicciones o trabajadores sociales es esencial para abordar de forma adecuada el problema de la recaída en el consumo alcohólico. Este abordaje permite prevenir la recidiva, interpretar mejor las diferentes conductas de recaída y su adecuado tratamiento[83].
Por otro lado, el paciente trasplantado por EHA presenta mayor riesgo cardiovascular que otras etiologías y es especialmente propenso a desarrollar cáncer de cabeza y cuello y pulmón. Por tanto, se deben evitar factores de riesgo especialmente modificables como el consumo de tabaco, la obesidad y el sedentarismo[83].
Conclusiones
La enfermedad hepática relacionada con el consumo de alcohol es un problema de salud pública que tiene su máxima expresión de gravedad en la HAA. La incidencia de HAA ha aumentado en los últimos años, especialmente durante la pandemia por SARS-CoV-2. En pacientes con HAA grave se recomienda iniciar prednisolona salvo infección activa o hemorragia digestiva activa. No existe evidencia de que otros tratamientos como la pentoxifilina o la N-acetil cisteína aumente la supervivencia en estos pacientes. La prevención del síndrome de abstinencia y el manejo nutricional individualizado son pilares fundamentales en el tratamiento de la HAA. En casos muy seleccionados con un primer episodio de HAA que no responde a tratamiento corticoideo, el trasplante hepático precoz ofrece un claro beneficio de supervivencia, pero el riesgo de recidiva etílica es significativo por lo que se requiere un abordaje multidisciplinar que incluya la evaluación y el seguimiento conjunto con el especialista en adicciones.

 Descargar número completo
Descargar número completo Download full issue
Download full issue