CITA ESTE TRABAJO
Torres Domínguez A, Pérez Estrada C, Ampuero Herrojo J. Actualización en el manejo de la insuficiencia hepática aguda sobre crónica. RAPD 2025;48(2):74-85. DOI: 10.37352/2025482.4
Introducción
La enfermedad hepática crónica presenta una historia natural compleja en la que se diferencian dos fases fundamentales: la fase compensada y la descompensada. La descompensación hepática, que confiere una disminución de la supervivencia a los 3-5 años, se define como el desarrollo de ascitis, encefalopatía hepática, hemorragia gastrointestinal, infección bacteriana o la combinación de éstas, y su aparición viene condicionada por la presencia de hipertensión portal clínicamente significativa, definida como un gradiente de presión venosa hepática ≥ 10 mmHg[1]. En los últimos años se han reconocido tres patrones de descompensación hepática que se diferencian en el curso clínico, el grado de inflamación sistémica y la supervivencia: la descompensación estable, inestable, o pre-ACLF[2].
La insuficiencia hepática aguda sobre crónica (ACLF de su acrónimo en inglés, acute-on-chronic liver failure), denominación propuesta por Jalan y Williams en 2002, es una descompensación aguda que se caracteriza por el fallo de órganos y la elevada mortalidad a corto plazo[3].
En los últimos años distintos grupos científicos se han esforzado en definir el concepto de ACLF; sin embargo, estas definiciones presentan importantes diferencias probablemente debido a las diferentes prevalencias de los factores desencadenantes y de la etiología de la enfermedad hepática de base en cada área geográfica.
A pesar de dicha heterogeneidad, éstos coinciden en que ACLF es una descompensación aguda con una fisiopatología y curso de la enfermedad diferente al resto de las descompensaciones habituales de la cirrosis.
En la actualidad destacan tres definiciones según la European Association for the Study of the Liver–Chronic Liver Failure (EASL-CLIF) Consortium, la Asian Pacific Association for the Study of Liver (APASL) y la North American Consortium for Study of End-stage Liver Disease (NACSELD), y cuyas diferencias más relevantes se recogen en la Tabla 1[4].
Tabla 1
Comparación de las definiciones de ACLF más extendidas.
La definición más extendida en nuestro medio es la del EASL-CLIF Consortium que nace del proyecto CANONIC, un estudio multicéntrico y prospectivo que incluyó a más de 1300 pacientes de 29 hospitales europeos que ingresaban por descompensación hepática aguda, y cuyo objetivo principal era definir el concepto de ACLF. Se concluyó que ACLF es una descompensación hepática aguda asociada a fracaso de órganos y a una elevada mortalidad (más del 30% a los 28 días), evaluándose el fallo de órgano mediante una escala modificada del conocido índice Sequential Organ Failure Assessment score (SOFA) que se denominó CLIF-C Organ Failure score (CLIF-C OF). Esta escala incluyó 6 sistemas de órganos (hígado, riñón, cerebral, circulación, respiratorio, coagulación), y según el número y tipo de fallo de órgano se diferenciaron diferentes grados de ACLF[5],[6]. La prevalencia de ACLF fue 30% (20% al ingreso y 10% durante el periodo de hospitalización), similar a estudios realizados en otras áreas geográficas[4].
Diferentes trabajos han puesto de manifiesto que los criterios de ACLF según la APASL y NACSELD en comparación con del EASL-CLIF Consortium infraestiman la mortalidad a 28 y 90 días de los pacientes con descompensación aguda hepática, pues un porcentaje no despreciable de ellos se diagnosticaría y estratificaría erróneamente de ACLF, lo que tendría implicaciones clínicas directas y especialmente en el ámbito del trasplante hepático[7],[8].
Fisiopatología
La fisiopatología de ACLF es tremendamente compleja y aún se desconocen muchos aspectos de los mecanismos responsables. Sin embargo, es bien sabido que la inflamación sistémica y la disregulación del sistema inmune juegan un papel esencial.
Esta hipótesis, que es la más aceptada en la actualidad, nace precisamente del estudio CANONIC en el que se objetivó que los niveles elevados de proteína C reactiva (PCR) y de leucocitos, que son marcadores proinflamatorios, se relacionaban con un peor pronóstico[5]. Los mecanismos responsables de esta inflamación sistémica abigarrada quedan reflejados en la Figura 1.
Figure 1
Inductores de la respuesta inflamatoria sistémica y mecanismos implicados en el fracaso de órganos.
Inductores de la inflamación sistémica
Los inductores de la respuesta inflamatoria sistémica pueden dividirse en:
A) Inductores exógenos. Son los conocidos patrones moleculares asociados a patógenos (PAMPs), moléculas procedentes de agentes bacterianos. Estos PAMPs no sólo se producen en el contexto de una infección bacteriana, como el clásico lipopolisacárido presente en la pared de las bacterias Gram negativas, sino que también proceden de la translocación bacteriana derivada del sobrecrecimiento bacteriano intestinal, aumento de la permeabilidad de la barrera intestinal y de la disfunción del sistema inmune intestinal en este contexto.
B) Inductores endógenos. Son los patrones moleculares asociado a daño molecular (DAMPs), productos de degradación celular originados por el daño de las células del huésped. Se conocen varios mecanismos de daño celular, como la apoptosis inducida por el alcohol en la hepatitis aguda alcohólica, la necrosis producida por la hepatitis por el virus de la hepatitis B o la isquemia-reperfusión hepática en casos de sepsis o hemorragia digestiva grave.
Estos PAMPs y DAMPs son reconocidos por los receptores reconocedores de patrones (PPRs) que se expresan en las células del sistema inmune innato, como los toll-like receptors (TLR). Su unión induce una cascada de señalización intracelular cuyo resultado final es la transcripción y síntesis de múltiples mediadores inflamatorios conocida como "tormenta de citoquinas"[4].
Mecanismos de fallo orgánico
La respuesta inmune exacerbada en el ACLF tiene tres implicaciones principales que conducen al fracaso de órganos:
1. Vasoconstricción sistémica e hipoperfusión. Los PAMPs estimulan la producción de óxido nítrico (NO) que causa una intensa vasodilatación sistémica y con ello una disminución del volumen arterial efectivo. Esto activa a los sistemas neurohormonales sistémicos (sistema renina-angiotensina-aldosterona y sistema simpático) y como consecuencia se produce vasoconstricción sistémica e hipoperfusión renal.
2. Disfunción mitocondrial. La disminución de la β-oxidación de ácido grasos mitocondriales de los órganos periféricos, lo que lleva a una disminución de la fosforilación oxidativa y de la producción de ATP y con ello a un agotamiento energético.
3. Daño tisular inmunomediado. La respuesta inflamatoria conduce a un daño tisular directo con la consecuente liberación de productos celulares que se comportan como DAMPs, lo que sustenta y exacerba esta respuesta inmune[9].
Estado de inmunosupresión
En los pacientes con ACLF se han observado alteraciones que conducen a una respuesta inmune compensatoria ineficaz, como la presencia de grupos celulares inmunes con funciones antimicrobianas defectuosas o la disminución de la producción de citocinas inflamatorias por los monocitos, lo que explicaría, entre otros aspectos, la susceptibilidad de estos paciente al desarrollo de infecciones bacterianas[4].
Diagnóstico de la insuficiencia hepática aguda sobre crónica
Fallo de órganos
Como se ha mencionado anteriormente, para evaluar la presencia y la severidad del fallo de órgano se usa la escala modificada CLIF-C OF (Tabla 2). El estudio CANONIC demostró que el fracaso de alguno de estos seis sistemas de órganos definidos por este índice y el número de órganos implicados se relaciona con un empeoramiento del pronóstico a los 28 días[5].
Tabla 2
Índice CLIF-C Organ Failure para el diagnóstico de fallo de órganos.
Severidad de ACLF
Según el fracaso y el número de órganos afectos (hígado, riñón, cerebral, circulación, respiratorio, coagulación), se clasifica el ACLF en diferentes grados como refleja la Tabla 3. Como novedad, se ha subdividido el grado 3 de ACLF en dos: grado 3a (tres fallos de órganos) y grado 3b (más de tres fallos de órganos)[6].
Tabla 3
Grados de insuficiencia hepática aguda sobre crónica.
Factores precimitantes de insuficiencia hepática aguda sobre crónica
El estudio PREDICT[2] es el único estudio prospectivo publicado hasta la fecha orientado a identificar factores precipitantes de ACLF, estableciendo una serie de desencadenantes principales: infecciones bacterianas, hepatitis aguda alcohólica grave, hemorragia gastrointestinal con inestabilidad, infección aguda por virus de la hepatitis E (VHE) y encefalopatía hepática aguda. En Europa y Estados Unidos, los principales desencadenantes son las infecciones bacterianas y el consumo excesivo de alcohol mientras que en Asia el factor más importante es la patología relacionada con el virus de hepatitis B (VHB). Sin embargo, hasta en un 30-40% de los casos no es posible identificar ningún factor precipitante a pesar de estudio exhaustivo.
Por otro lado, el número de precipitantes que se identifican simultáneamente se considera un factor pronóstico y resultan determinantes en la evolución a corto plazo de los pacientes con ACLF. Por consiguiente, los pacientes con dos o más precipitantes reconocidos tienen una mayor mortalidad a los 90 días respecto a aquellos con uno o ningún factor identificado.
La combinación más frecuentemente hallada es la constituida por las infecciones bacterianas y hepatitis aguda alcohólica. Sin embargo, en el estudio de Fernández et al.[10], la presencia de infección bacteriana tanto en el diagnóstico como en el seguimiento de pacientes con ACLF-1 y ACLF-2 fue descrita como un factor independiente de mortalidad.
Por todo ello, ante un paciente con ACLF es indispensable realizar una búsqueda activa de los factores precipitantes conocidos más frecuentes:
a) Factores intrahepáticos
-Hepatitis aguda alcohólica:
-Diagnosticada tanto en base a criterios clínicos como histológicos.
-Primoinfección o reactivación de hepatitis virales:
-VHB, sobre todo en Asia.
-VHE, sobre todo en los casos en los que desencadene un daño hepático importante definido como AST y ALT >400 UI/ml y bilirrubina total > 3mg/dl[6].
b) Factores extrahepáticos
-Infecciones bacterianas:
-La translocación bacteriana desempeña un papel fundamental al facilitar la circulación sistémica de PAMPs (patrones moleculares asociados a patógenos).
-Ejemplos: peritonitis bacteriana espontánea, empiema bacteriano espontáneo, bacteriemia espontánea o secundaria tras procedimiento invasivo, infección del tracto urinario, neumonía, bronquitis, infecciones cutáneas, colangitis, peritonitis bacteriana secundaria o infección por Clostridium difficile.
-Hemorragia gastrointestinal inestabilizante:
-La hemorragia por varices gastroesofágicas es la entidad más relevante en este apartado, aunque cualquier otra hemorragia digestiva que implique inestabilidad hemodinámica o alteración hematimétrica significativa (pérdida de 2 o más puntos de hemoglobina) puede ser un precipitante de ACLF.
-Encefalopatía desencadenada por fármacos:
-Principalmente medicación sedante, sobre todo benzodiacepinas u opioides.
-Otros fármacos a dosis estándar: inhibidores de la bomba de protones, antibióticos (penicilina/tazobactam, meropenem, ciprofloxacino, norfloxacino, metronidazol) o antifúngicos (fluconazol).
-Daño renal inducido por fármacos:
-Principalmente antiinflamatorios no esteroideos, antagonistas del eje renina-angiotensina-aldosterona, antagonistas alfa-1 adrenérgicos, contraste yodado intravenoso o antibióticos (vancomicina, aminoglucósidos), entre otros.
En caso de que tras un examen exhaustivo del paciente no se haya identificado ninguna de las entidades descritas previamente, se deberá descartar causas más raras, siempre bajo sospecha clínica en función de la situación del paciente:
a) Factores intrahepáticos:
-Infecciones virales: sobreinfección por virus de la hepatitis delta en pacientes con hepatitis VHB, infección por virus de la hepatitis A o infección por virus de la hepatitis C.
-Daño hepático desencadenado por fármacos (DILI por las siglas en inglés).
-Enfermedad de Wilson.
-Brote de hepatitis autoinmune
-Hepatitis isquémica.
b) Factores extrahepáticos:
-Infecciones virales: virus Epstein Barr, Citomegalovirus, virus de la Inmunodeficiencia Humana, virus herpes Simple, virus Varicela-Zóster, Parvovirus B19, SARS-CoV-2, virus de la gripe A y B, virus respiratorio sincitial.
-Infecciones parasitarias como la Leishmaniasis visceral.
-Intervenciones quirúrgicas o radiológicas invasivas en los 7 días previos.
Opciones terapéuticas en la insuficiencia hepática aguda sobre crónica
El tratamiento del ACLF debe ser integral y multidisciplinario, abordando tanto el manejo específico de los factores precipitantes como el soporte de los órganos afectados, ofreciendo un tratamiento individualizado atendiendo a la gravedad clínica.
Tratamiento de soporte de órganos en Unidad de Cuidados Intensivos
Los pacientes con ACLF, especialmente los grados más graves, a menudo necesitan ingresar en Unidades de Cuidados Intensivos (UCI) para asegurar una monitorización estrecha o para recibir tratamiento de soporte (respiratorio, circulatorio, etc). El acceso a estas unidades a veces no es fácil, pues clásicamente ha existido la idea preconcebida de que estos pacientes tienen un pronóstico infausto a pesar de recibir estas medidas de soporte y por tanto se consideran fútiles. Sin embargo, trabajos recientes han refutado este concepto demostrando que el tratamiento de soporte mejora el pronóstico de los pacientes con enfermedad hepática avanzada y son comparables con el resto de población[11]. Por tanto, los pacientes con ACLF deben ser valorados como el resto de la población general independiente de su enfermedad hepática de base, y las comorbilidades que presenten deben evaluarse caso por caso.
Las indicaciones principales de ingreso en UCI son:
-Monitorización estrecha que no pueda asegurarse en planta de hospitalización.
-Necesidad de medidas de soporte de órganos: drogas vasoactivas, ventilación mecánica, terapia de reemplazo renal.
-Aislamiento de la vía aérea por hemorragia digestiva masiva o encefalopatía hepática grado III/IV de West-Eaven.
-Shock séptico.
Por otro lado, la limitación del soporte vital debe ser considerada en los siguientes escenarios:
-Comorbilidades asociadas a un pronóstico infausto.
-Situación basal previa limitada.
-Neoplasia avanzada con esperanza de vida < 6 meses.
-Fragilidad secundaria a sarcopenia severa o un índice de Karnofsky ≤ 40.
-Fracaso de 4 órganos o más o un índice CLIF-C ACLF > 70 puntos tras 3-7 días de estancia en UCI en paciente sin opciones a trasplante hepático.
Tratamiento de los factores precipitantes
A continuación, se detallan las estrategias terapéuticas para los principales desencadenantes.
1. Infecciones bacterianas
Como se ha comentado previamente, las infecciones bacterianas son frecuentes en pacientes con ACLF, presentando una alta prevalencia al diagnóstico (37%) y una incidencia del 46% en las primeras 4 semanas[10]. Suelen cursar con mayor gravedad requiriendo mayor tiempo de estancia en UCI y además se asocian con mayor frecuencia a microorganismos multirresistentes. Por todo ello, es importante mantener siempre una alta sospecha con la intención de instaurar el tratamiento de forma precoz:
-Antibioterapia empírica precoz ante sospecha de infección o un deterioro clínico no explicado. Se recomienda uso de antibióticos de amplio espectro adaptados a resistencias locales y factores de riesgo individuales.
-Ajuste de la terapia antibiótica: se recomienda una desescalada precoz (24-72 horas) del tratamiento, si es posible guiado según cultivo y sensibilidad.
-Tratamiento antifúngico empírico: la incidencia de infección fúngica en pacientes con ACLF es de 2-16%[12] por lo que se podría considerar el tratamiento empírico en caso de shock séptico nosocomial. Las etiologías más prevalentes son la candidiasis (70-90%) y la aspergilosis (10-20%) invasivas.
-Ajuste de dosis del antimicrobiano según características del paciente, si es preciso, y monitorización de la respuesta clínica y microbiológica.
2. Hepatitis B
En la reactivación de VHB con ACLF, la mortalidad a los 3 meses alcanza el 50-55%[13] en casos no trasplantados. Los análogos de núcleo(s)tidos han demostrado mejorar la supervivencia, sin diferencias significativas entre tenofovir y entecarvir. Por lo expuesto previamente:
-Iniciar tratamiento antiviral precozmente sin esperar al resultado del ADN viral.
-Considerar trasplante hepático especialmente en casos graves (MELD >30, ACLF 2-3) con ausencia de respuesta virológica precoz (reducción menor de 2 log en las primeras 2 semanas) y/o ausencia de mejoría clínica.
3. Hepatitis aguda alcohólica
El manejo de los pacientes con hepatitis aguda alcohólica grave y ACLF debe ser multifactorial, abarcando la abstinencia alcohólica, la prevención del síndrome de deprivación, el soporte nutricional, corticoides y, en casos seleccionados, puede valorarse el trasplante hepático.
-Uso limitado de corticoides: Según aumenta la gravedad del ACLF disminuye la eficacia (52.2% ACLF-1 vs 8.3 ACLF-3)[14] y aumenta el riesgo de infección bacteriana. Por ello, no se recomienda su uso en pacientes con ACLF-3 ni tampoco en caso de infección activa no controlada.
-Despistaje de infecciones: Se recomienda antes y durante el tratamiento con corticoides.
-Falta de respuesta: La ausencia de respuesta a corticosteroides en pacientes con ACLF se asocia a un mayor riesgo de infecciones (83.3% vs 57.7%)[14].
4. Hepatitis autoinmune
En pacientes con ACLF por hepatitis autoinmune (HAI) puede ser necesaria la biopsia hepática para confirmar diagnóstico (sobre todo en los casos de HAI seronegativa) y/o para diferenciarla de un fallo hepático agudo. El uso de corticoides es controvertido y debe individualizarse.
-Existe actualmente poca evidencia en estos casos.
-Parece que aumenta la supervivencia a los 3 meses en pacientes sin sepsis al ingreso (p =0.02), reduce el tiempo de estancia en UCI (p <0.0001) con una incidencia similar de sepsis durante la evolución (p = 0.32)[15].
-Está contraindicado en caso de infección activa no controlada.
-Se ha descrito una prevalencia de infección bacteriana del 76% al ingreso[16], lo cual limita el número de pacientes que podrían beneficiarse del tratamiento.
- Durante el tratamiento debe realizarse un seguimiento estrecho de eficacia y despistaje de infecciones.
Según opiniones de expertos[17], si no existe mejoría de bilirrubina o de MELD-Na en los primeros 7 días, podría valorarse suspender el tratamiento y plantear la necesidad de un trasplante hepático.
5. Hemorragia por rotura de varices esofágicas
El tratamiento de esta situación en ACLF debe ajustarse a las recomendaciones generales.
-TIPS: el riesgo de resangrado de estos pacientes es casi el doble, por lo que la posibilidad de TIPS, tanto preventivo como de rescate, debe considerarse. La encefalopatía hepática aguda no debería considerarse una contraindicación.
-En el estudio de Trebicka et al.[18], se describe una reducción de la mortalidad del 75%, aunque solo incluye pacientes con ACLF-1 y 2.
-Otro estudio[19] concluye que a mayor puntuación de MELD, mayor es el impacto en la supervivencia tras un TIPS preventivo.
-Betabloqueantes no selectivos (BBNS):
-Durante el evento, la decisión de mantenerlos, suspenderlos o reducir la dosis debe ser individualizada.
-Tras el episodio de ACLF se recomienda iniciar o reiniciar BBNS con dosis progresivas para asegurar una PAM > 65mmHg. Aunque no existen estudios específicos, se recomienda su uso por su efecto beneficioso sobre la inflamación sistémica.
Pronóstico
El desarrollo de ACLF, como se ha comentado previamente, se acompaña de una elevada mortalidad (30-50% aproximadamente a los 28 días), describiéndose a lo largo de los últimos años distintos factores de riesgo como la ascitis, hipotensión arterial, anemia u obesidad, destacando dos que se objetivaron en el estudio CANONIC[5]:
Primera descompensación hepática. Se puso de manifiesto que los pacientes que no habían tenido descompensaciones hepáticas previas (20%) presentaban un curso de la enfermedad más grave y por tanto, una menor supervivencia a corto plazo. Estos pacientes quedan excluidos según la definición de APASL.
Nivel de PCR y leucocitos. Los pacientes con ACLF presentaban niveles de leucocitos y PCR más elevados respecto a los que no cumplían criterios de ACLF, relacionándose proporcionalmente con un peor pronóstico.
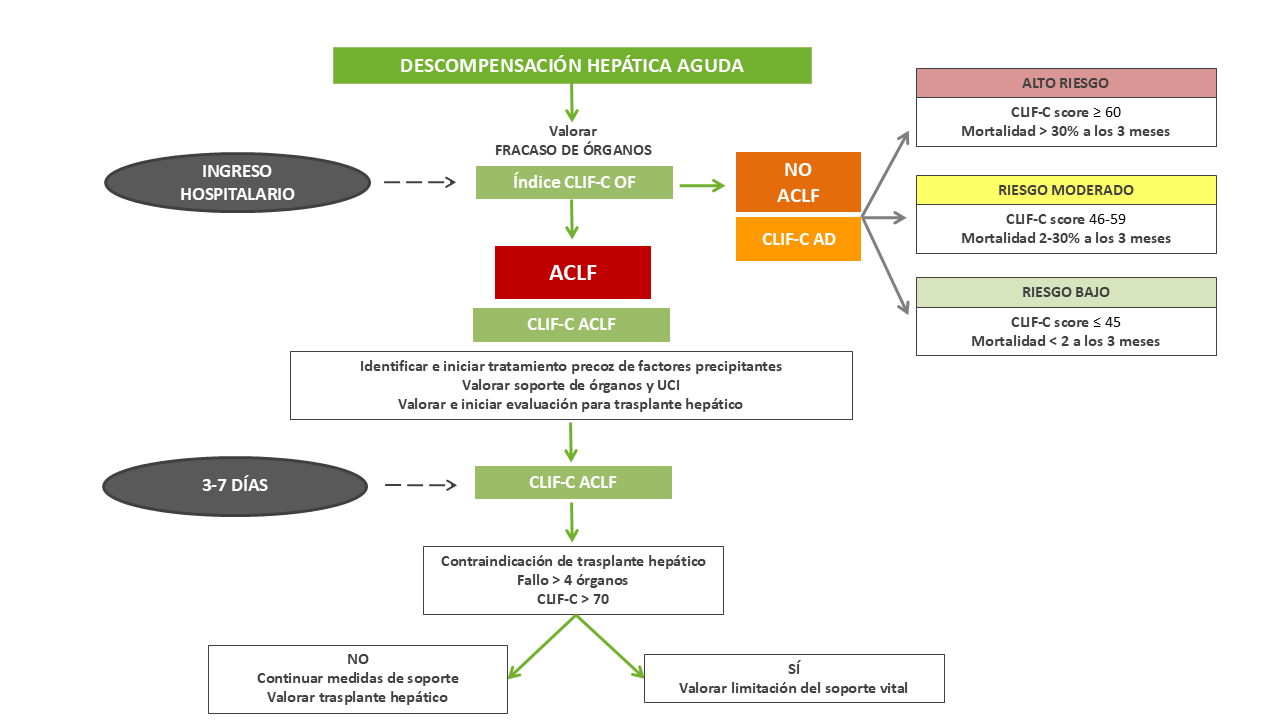
A pesar de esta elevada mortalidad, ACLF es una entidad dinámica y potencialmente reversible. La evolución clínica a los 3 y 7 días de la hospitalización es el mejor predictor pronóstico y no la gravedad inicial del cuadro[20], y por tanto, cobra especial importancia la evaluación minuciosa del pronóstico para la correcta estratificación del riesgo y con ello facilitar la toma de decisiones, que pueden ir desde la valoración del trasplante hepático a la limitación del soporte vital.
Para ello se diseñó a partir de los datos del estudio CANONIC el índice CLIF-C ACLF, que combina el índice CLIF-C OF con la edad y el recuento leucocitario, y es más preciso que el índice MELD, MELD-Na y Child-Pugh a la hora de predecir la mortalidad a los 28 y 90 días[5],[21].
Evaluación pronóstica de pacientes sin ACLF
Aunque la mortalidad a corto plazo de los pacientes que ingresan por una descompensación aguda hepática sin criterios de ACLF es menor, es importante identificar a los pacientes de alto riesgo para monitorizarlos de forma estrecha y prevenir la progresión a ACLF[6].
De igual manera que el índice CLIF-C ACLF, se elaboró el índice CLIF-C AD para los pacientes sin criterios de ACLF, conformado por la edad, el sodio sérico, el recuento leucocitario, la creatinina y el INR. Este índice, validado interna y externamente, proporciona una puntuación del 0 al 100 y clasifica a los pacientes en tres grupos de riesgo5. Este índice también predice mejor la mortalidad a 90, 180 y 365 días que el índice MELD, MELD-Na y Child-Pugh[22].
Ambos índices pueden ser calculados en la web https://efclif.com/research-infrastructure/score-calculators/clif-c-of-aclf-ad/ . En la Figura 2 se refleja el algoritmo propuesto para evaluar el pronóstico de los pacientes que ingresan por descompensación hepática aguda.
Trasplante hepático
El trasplante hepático (TH) es el único tratamiento definitivo que ha demostrado mejorar la supervivencia en pacientes con ACLF. Su beneficio es particularmente importante en pacientes con ACLF-3, quienes tradicionalmente han sido considerados candidatos fútiles.
Consideraciones generales para el trasplante en ACLF
-Impacto positivo:
-El TH debe considerarse en los casos de ACLF grave (grados 2-3) ya que puede revertir el fallo multiorgánico secundario y se asocian a una clara mejoría de la supervivencia respecto a aquellos no trasplantados (80.9% vs 10%, a los 6 meses[20]).
-Además, se han descrito tasas de supervivencia comparables a las de otros grupos de trasplantados (86% en ACLF-2 vs 90% sin ACLF, al año[23]).
-Ventana terapéutica:
-Es esencial la identificación precoz de candidatos debido al riesgo de infección y a la rápida progresión del ACLF que puede condicionar fallos orgánicos irreversibles, ambos posibles motivos de contraindicación de TH.
-Los pacientes con ACLF grados 2 y, especialmente 3, deben ser priorizados en las listas de espera dado que el retraso en el TH se relaciona con el aumento de mortalidad tanto en lista de espera (casi el 50% al año en ACLF-3[24]) como en el post-trasplante.
-Obstáculos:
-A pesar de los resultados favorables en cuanto a supervivencia, también se ha descrito una mayor tasa de complicaciones (sobre todo vasculares y biliares) y mayor tiempo de estancia hospitalaria y en UCI, especialmente en ACLF-3.
Consideraciones en ACLF -3
-Resultados prometedores:
-Históricamente, los pacientes con ACLF-3 han sido considerados fútiles para TH debido a su alta mortalidad sin intervención.
-Evidencias recientes refutan esta percepción demostrando tasas de supervivencia al año del 84% y de 60-70% a los 5 años[23], similar a otros grupos de pacientes trasplantados.
-Sin embargo, dado el delicado equilibrio clínico de estos pacientes y el mayor porcentaje de complicaciones derivadas del TH, es necesario realizar estudios para establecer criterios firmes de futilidad en este grupo.
Abordaje multidisciplinario
-Criterios de selección:
-La selección de candidatos debe ser precisa, teniendo en cuenta factores como comorbilidades, infecciones activas y disfunciones irreversibles.
-Los equipos multidisciplinarios deben incluir hepatólogos, intensivistas y cirujanos de trasplante para evaluar y priorizar adecuadamente.
-Terapias puente y estabilización:
-El objetivo principal en los pacientes en lista de espera para TH debe ser mantener la estabilidad clínica.
-Tecnologías como el MARS® y la plasmaféresis pueden estabilizar a los pacientes y mejorar su estado antes del TH.
-En algunos casos, los donantes vivos o con criterios expandidos ofrecen alternativas viables para pacientes en situación crítica, especialmente ACLF-3.
Perspectivas futuras y áreas de investigación
-Protocolos de organización de lista de espera:
-Es necesario implementar protocolos de priorización que tengan en cuenta la progresión rápida del ACLF dado que el actual basado en MELD (Na) infraestiman la mortalidad de estos pacientes.
-Biomarcadores:
-Estudios recientes buscan identificar biomarcadores que permitan una estratificación precisa del riesgo y una priorización basada en pronósticos objetivos[25],[26].
-Estrategias en TH:
-Uso de donantes vivos, tecnologías de preservación de órganos o la optimización inmunológica, entre otros.
En conclusión, el TH es una opción terapéutica esencial para pacientes con ACLF, incluso en sus formas más avanzadas. La percepción de futilidad debe ser reemplazada por un enfoque basado en la evidencia, que respalde el potencial del trasplante para transformar el pronóstico y calidad de vida de estos pacientes.
Conclusiones
La insuficiencia hepática aguda sobre crónica es una entidad grave y diferente al resto de descompensaciones habituales de la cirrosis, consecuencia de la respuesta inflamatoria sistémica exacerbada y la disfunción del sistema inmune del huésped. Es indispensable su diagnóstico precoz, el tratamiento de los factores precipitantes y el soporte de órganos en Unidad de Cuidados Intensivos cuando lo precise, sin que la enfermedad hepática de base suponga una limitación para el acceso a estas unidades especializadas. La evolución clínica a los 3 y 7 días del ingreso es el mejor predictor pronóstico, por lo que es fundamental su evaluación sistemática durante el seguimiento mediante el uso de índices como el CLIF-C ACLF. El trasplante hepático constituye una opción terapéutica esencial en las formas graves de ACLF, y resulta necesario implementar protocolos de priorización para disminuir la mortalidad en lista de espera.

 Descargar número completo
Descargar número completo Download full issue
Download full issue