CITA ESTE TRABAJO
Berdugo Hurtado F. Manejo del fracaso renal en el paciente con enfermedad hepática crónica avanzada. RAPD 2025;48(5):196-211. DOI: 10.37352/2025485.2
Introducción
La disfunción o insuficiencia renal aguda (IRA o AKI, por sus siglas en inglés: Acute Kidney Injury) constituye unas de las complicaciones más frecuentes en los pacientes con enfermedad hepática crónica avanzada (EHCA), alcanzando una prevalencia variable entre el 27 y el 53% de los pacientes hospitalizados con EHCA descompensada[1]. En general, la IRA se asocia con una alta tasa de morbimortalidad y una mayor incidencia de enfermedad renal crónica después del trasplante hepático. La progresión a etapas avanzadas de la IRA presagia un peor pronóstico en el paciente cirrótico[2],[3]. En 2012, la Iniciativa de Calidad de las Enfermedades Agudas (ADQI) y el Club Internacional de la Ascitis (ICA) promulgaron unos nuevos criterios diagnósticos para la IRA[4]; los cuales han sido recientemente revisados en 2023-24 dados los avances significativos producidos en este campo en la última década[5].
Definiciones y clasificación
En la actualidad, definimos IRA como el aumento de la creatinina sérica (sCr) ≥ 0.3 mg/dl en menos de 48 horas o por un aumento porcentual de la sCr ≥ 50% respecto al valor basal en los últimos 7 días[6],[7]. Como nuevo criterio en el último consenso de la ADQI e ICA, se propone incluir como criterio de IRA una producción de orina (UO) ≤ 0.5ml/kg durante ≥ 6 horas, teniendo en cuenta la dificultad para la monitorización estrecha de la misma y que en las horas iniciales del seguimiento de estos pacientes con EHCA puede ser baja. Aun así, recalcamos la introducción de este nuevo criterio, no tanto como criterio diagnóstico, sino como criterio para tener en cuenta para detectar más tempranamente a los pacientes con IRA y así actuar de forma precoz[5],[8]. A su vez, la IRA se estadifica en distintos grados según el aumento porcentual de la sCr desde el inicio, el cual desglosamos en la siguiente tabla 1.
Tabla 1
Definiciones y criterios de enfermedad renal según el consenso ADQI-ICA.
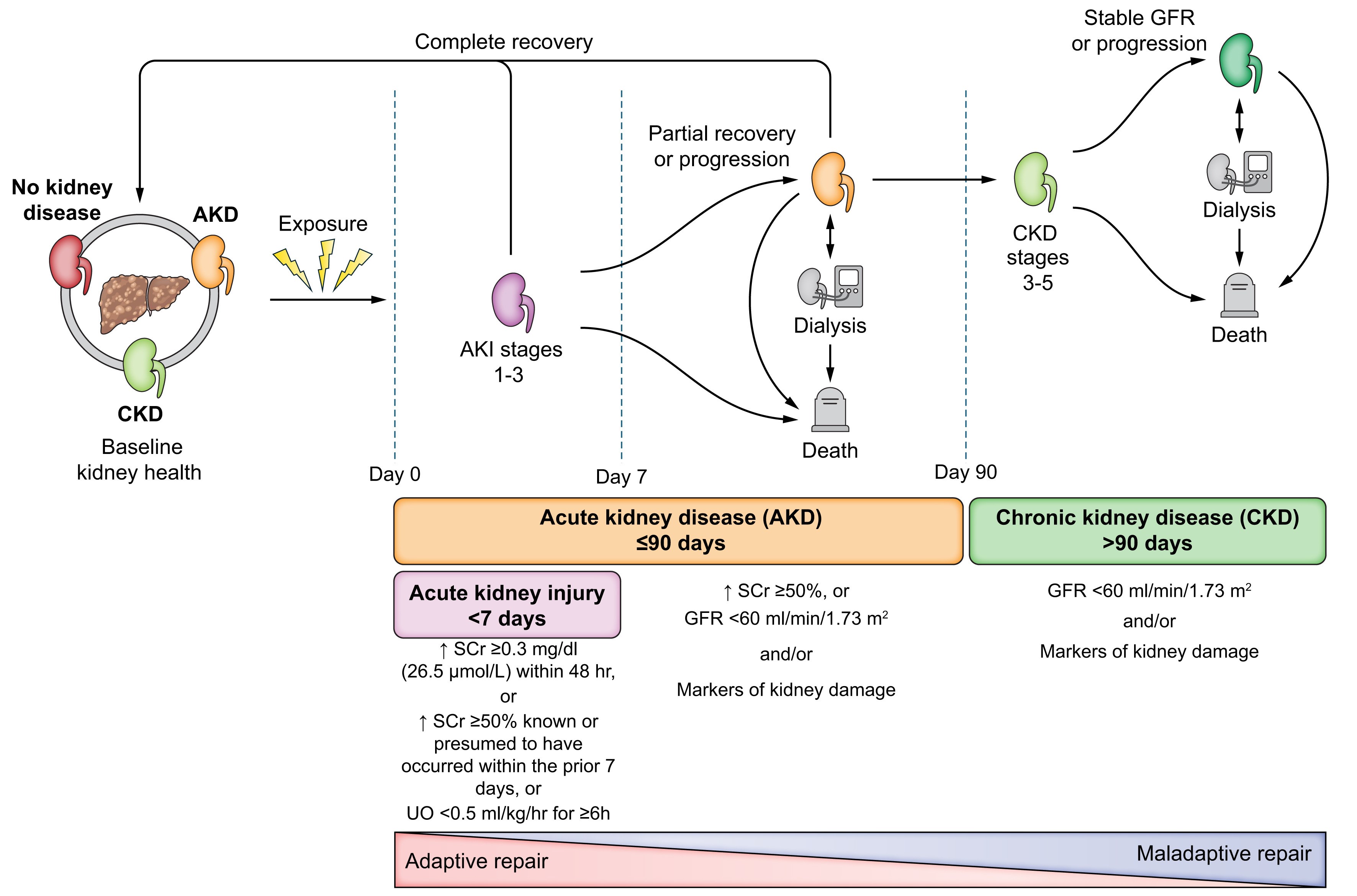
En el consenso de la ADQI-ICA5, se nos recomienda utilizar como valor basal de sCr, el valor estable más bajo obtenido en los últimos 3 meses, o en su defecto de no ser posible, el valor estable más bajo hasta 12 meses antes. Siendo este seguimiento del valor basal de sCr el que nos permitirá discernir IRA, de la enfermedad renal aguda (ERA o AKD, por sus siglas en inglés: Acute Kidney Disease) y enfermedad renal crónica (ERC o CKD, por sus siglas en inglés: Cronic Kidney Disease) (Tabla 1, Figura 1)[5]-[7],[9]: ▪ Enfermedad renal aguda (ERA): tasa de filtrado glomerular (TFG) < 60 ml/min/1.73m2 o aumento porcentual de la sCr ≥ 50% (1.5-2 veces) respecto al valor basal en ≤ de 3 meses. Siguiendo por tanto la definición, podemos entender que la IRA es un subconjunto de la enfermedad renal aguda (Figura 1). ▪ Enfermedad renal crónica (ERC): tasa de filtrado glomerular (TFG) < 60 ml/min/1.73m2 que persiste durante > de 3 meses. Pudiendo dentro de la misma, producirse episodios de disfunción renal aguda, sobre los cuales deberemos actuar.
Figura 1
Evolución de la disfunción renal en el paciente con enfermedad hepática crónica avanzada. Extraído de: Nadim MK, Kellum JA, Fomi L, et al. Acute kidney injury in patients with cirrhosis: Acute Disease Quality Initiative (ADQI) and International Club of Ascites (ICA) joint multidisciplinary consensus meeting. J Hepatol. 2024; 81: 163-83.
Etiología y fisiopatología de la enfermedad renal
Principales etiologías:
Podemos definir tres grandes grupos como causas de IRA en el paciente cirrótico, los cuales pueden coexistir en un mismopaciente[3],[10],[11]:
Prerrenal: producida por una hipoperfusión renal, es la causa más frecuente de esta disfunción en el paciente cirrótico. Destacamos como etiologías en este grupo, la hipovolemia (27-50% casos) y el síndrome hepatorrenal (15-20%).
Intrínseca: derivada de un daño directo sobre el parénquima renal. El principal factor etiológico de este grupo la necrosis tubular aguda (NTA) (14-30%), que puede ocurrir en los casos de shock hipovolémico o séptico o también por la acción directa de fármacos nefrotóxicos o contrastes yodados. Otros procesos a tener en cuenta son todos aquellos que derivan en un evento de nefritis intersticial aguda (NIA) como: nefropatía por ácidos biliares, glomerulonefritis (IgA mediada en pacientes alcohólicos o membranosa/membranoproliferativa en cirróticos por VHB/VHC).
Postrenal: engloba a aquellos procesos que producen una obstrucción de la vía urinaria (litiasis, tumores…). Suele acontecer en menos del 1% de los casos.
Síndrome hepatorrenal
El síndrome hepatorrenal (SHR) es un fenotipo de IRA prerrenal que aparece en pacientes con EHCA y ascitis, caracterizada por un deterioro de la función renal secundario a una perfusión renal reducida a través de alteraciones hemodinámicas en la circulación arterial y la hiperactividad de los sistemas vasoactivos endógenos. La inflamación sistémica contribuye a los trastornos neurohumorales y vasodilatadores que dan lugar a este tipo de disfunción renal, la cual es persistente a las terapias de expansión de volumen y pueden llegar a ser reversibles con terapia vasoconstrictora[12]-[14]. Es por ello, fundamental que en todo paciente con EHCA y ascitis que presenten IRA, llevemos a cabo una evaluación y diagnóstico etiológico diferencial adecuados y rápidos, con el fin de garantizar el reconocimiento y manejo oportuno etiológico, teniendo siempre en cuenta la posibilidad de coexistencia de distintas causas de IRA[3][5],[12]. En la actualidad, tras los últimos consensos alcanzados, podemos desechar los antiguos conceptos de SHR tipo 1 y tipo 2; siendo reemplazados por los términos SHR-IRA, SHR-ERA y SHR-ERC, cuyos criterios diagnósticos desarrollamos en la siguiente tabla (Tabla 2)[5]:
Tabla 2
Criterios de diagnóstico de SHR según consenso ADQI-ICA 2024
Hay que destacar de estos nuevos criterios diagnósticos, frente a los establecidos previamente[5],[15]-[17]:
- Valorar respuesta a expansión de volumen con albúmina durante 48 horas: se excluye dicho criterio dado que en pacientes euvolémicos o con sobrecarga de líquido intravascular, 48 horas de infusión con albúmina puede ser perjudicial favoreciendo el acúmulo de líquido y retrasando el diagnóstico e inicio de terapia vasoconstrictora.
- No mejoría de función renal a pesar de expansión de volumen adecuada durante 24 horas: se recomienda evaluar el estado de volemia del paciente durante 24 horas con una perfusión adecuada de líquidos intravenosos, bien de sustancias cristaloides balanceadas (Ringer Lactato o PlasmaLyte) o bien solución de albúmina al 20%, a razón de 1g/kg de peso (máximo 100g al día), en función de la situación clínica del paciente. Si no hay mejoría de la sCr en 24 horas, se debe considerar el diagnóstico de SHR-IRA.
- Coexistencia de otras etiologías: la presencia de enfermedad renal subyacente no excluye en la actualidad un diagnóstico superpuesto de SHR, es por ello, que el SHR puede coexistir con otras causas de IRA, las cuales siempre debemos tener en cuenta en el diagnóstico. Por tanto, en todo paciente con IRA o sospecha de SHR debemos buscar una explicación alternativa como shock séptico que requiera vasopresores, necrosis tubular aguda, obstrucción renal…
Distinguiremos, por tanto, entre SHR tipo IRA, ERA o ERC según el momento y la duración de la disfunción renal. El SHR que dura menos de 90 días se clasificaría como SHR-ERA, mientras que el que perdure durante más de 90 días se clasificaría como SHR-ERC[5].
Ejemplo 1: Paciente con SHR-ERA basal que en evolución desarrolla disfunción renal aguda o IRA, este paciente debe ser catalogado en este nuevo momento como SHR-IRA.
Ejemplo 2: Paciente con EHCA y ERC preexistente por nefropatía diabética, que desarrolla una disfunción renal aguda con criterios de SHR, este paciente será clasificado como SHR-IRA en ERC.
Fisiopatología:
Los pacientes con EHCA, y particularmente aquellos con ascitis, tienen una mayor susceptibilidad a la IRA debido a las alteraciones hemodinámicas que resultan de la hipertensión portal. Siendo el grado de alteración de la función hepática, renal y circulatoria junto con los eventos precipitantes, los que pueden dar lugar a una variedad de fenotipos clínicos de IRA[3],[5],[18],[19].
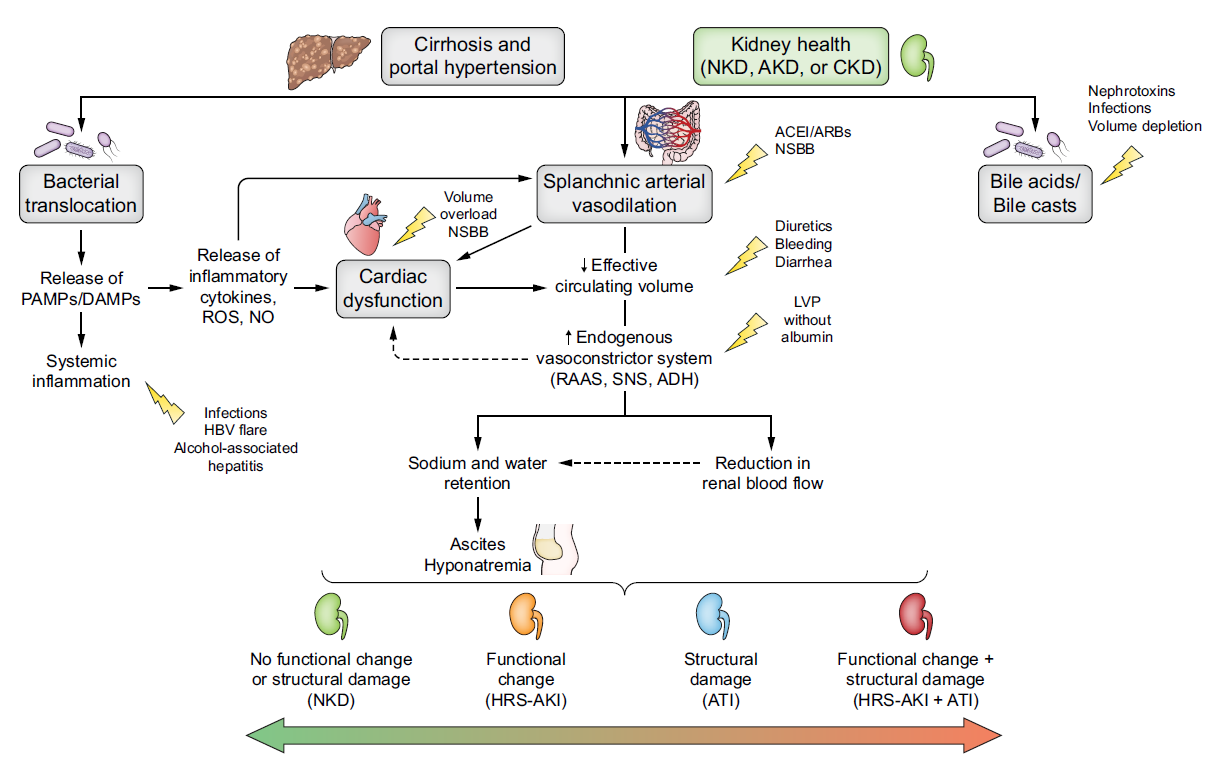
La fisiopatología de esta disfunción se sustenta en 4 ejes (Figura 2), siendo la base de todo, la hipertensión portal:
Figura 2
Fisiopatología de la disfunción renal en el paciente con enfermedad hepática crónica avanzada y noxas desencadenantes. Extraído de: Nadim MK, Kellum JA, Fomi L, et al. Acute kidney injury in patients with cirrhosis: Acute Disease Quality Initiative (ADQI) and International Club of Ascites (ICA) joint multidisciplinary consensus meeting. J Hepatol. 2024; 81: 163-83.
Disfunción circulatoria sistémica
El mecanismo inicial en la patogenia de la hipertensión portal es el aumento de la resistencia intrahepática secundaria a la distorsión de la arquitectura hepática y/o aumento del tono vascular del eje esplácnico. Este aumento de la resistencia junto con el estado proinflamatorio sistémico derivado de la enfermedad hepática y la reducción de la eliminación hepática de sustancias endógenas favorece la mayor producción de factores vasodilatadores endógenos como el óxido nítrico, monóxido de carbono y endocannabinoides en la circulación esplácnica. Estos mediadores vasodilatadores promueven la vasodilatación arterial esplácnica, provocando una redistribución del flujo sanguíneo sistémico hacia este territorio vascular esplácnico, disminuyendo así la perfusión arterial de otros territorios vasculares (hipovolemia arterial efectiva). Como resultado de todo ello, la presión arterial media (PAM) disminuye, favoreciendo la activación de mecanismos compensatorios; principalmente el sistema renina-angiotensina-aldosterona (SRAA), el sistema nervioso simpático (SNS) y la argina vasopresina. Estos sistemas se activan progresivamente con el fin de mantener la presión sanguínea, el volumen sanguíneo arterial efectivo y la perfusión renal; lo que conlleva a un estado de circulación hiperdinámica.
A medida, que la enfermedad hepática progresa, la hipertensión portal y la vasodilatación esplácnica aumentan; lo que conlleva a una hiperactivación de los sistemas compensatorios hasta tal punto que se produce un aumento de la retención de agua y sodio libre de solutos, provocando una hipovolemia arterial efectiva que se traduce en el desarrollo entre otros de ascitis, edema o hiponatremia hipervolémica[3],[20],[21].
Vasoconstricción renal
A nivel renal, como consecuencia de este estado de hipovolemia y activación progresiva del SRAA y SNS, se produce una vasoconstricción de las arterias renales y una reducción de la tasa de filtración glomerular.
En condiciones fisiológicas, el flujo sanguíneo renal se mantiene constante a pesar de las variaciones de la presión arterial, fenómeno conocido como autorregulación de la circulación renal. En fases avanzadas de la enfermedad hepática, este equilibrio se pierde conduciendo a un aumento desproporcionado de la resistencia vascular renal, produciéndose así una disminución de la perfusión renal y de la tasa de filtración glomerular[22]-[24].
Disfunción cardiaca
En las fases iniciales de la EHCA con hipertensión portal asociada, se favorece un estado circulatorio hiperdinámico con el fin de mantener la PAM en rango normal y la perfusión tisular. Este estado hiperdinámico se caracteriza por un aumento del gasto cardiaco, la frecuencia cardiaca y un aumento del volumen plasmático. Sin embargo, en las etapas avanzadas de la enfermedad tras un largo periodo manteniendo este estado hiperdinámico, se produce una disfunción cardiaca tanto sistólica como diastólica (denominada "miocardiopatía cirrótica"), que contribuyen en el estado de hipoperfusión renal[25],[26].
Estado proinflamatorio
La inflamación sistémica es un estado común en el paciente con EHCA descompensada, presentando niveles elevados de citocinas proinflamatorias como la interleucina 6, factor de necrosis tumoral α y proteína C reactiva, entre otros. Se asocia este estado de proinflamación en el paciente cirrótico, con un aumento en estos pacientes de la permeabilidad intestinal; favoreciendo así la traslocación bacteriana del intestino a la circulación portal. El paso de bacterias al torrente sanguíneo activa a las células presentadoras de antígenos (macrófagos, monocitos y células dendríticas) a través de los patrones moleculares asociados a patógenos (PAMPs), endotoxinas y ADN bacteriano. Además de estos factores asociados a la traslocación bacteriana, el paciente cirrótico presenta un estado proinflamatorio secundario al daño de las células hepáticas inducidos por las diferentes noxas causantes de la enfermedad, que provocan la liberación de moléculas asociadas al daño (DAMPs) como el ácido úrico, proteínas S100...; que también promueven la activación del sistema inmune innato. Por tanto, toda la activación de células inmunes innatas favorece la liberación de citoquinas proinflamatorias y vasodilatadoras, lo que conlleva a un aumento de la vasodilatación sistémica y empeoramiento del estado circulatorio hiperdinámico de estos pacientes[27]-[32].
Factores precipitantes
Este fracaso renal puede suceder de forma espontánea secundario a la progresión de la enfermedad y agotamiento del sistema compensador, o bien asociarse a una serie de factores precipitantes[3],[5]:
-Potenciación del estado proinflamatorio: procesos infectivos, principalmente la peritonitis bacteriana espontánea (desencadenante más frecuente de IRA); persistencia de noxas hepáticas activas (alcohol, VHB, VHC…)
- Depleción de volumen sistémico: hemorragia digestiva, paracentesis evacuadoras de gran volumen, diuresis excesiva (uso excesivo de diuréticos), diarrea/deshidratación…
- Disfunción circulatoria: ascitis refractaria, inducción de vasodilatación por fármacos (IECA, ARA II, betabloqueantes…), alteración sistema autorregulación circulación renal (AINEs)
- Daño renal: sustancias nefrotóxicas (AINEs, aminoglucósidos, contraste yodado…).
Diagnóstico y evaluación de la función renal
La evaluación diagnóstica de los pacientes con EHCA e IRA debe basarse en conocer el estado del volumen intravascular, la evaluación de la función renal y la detección exhaustiva de posibles factores desencadenantes y fenotipificación de la IRA[5].
Evaluación del volumen intravascular
Hoy en día, sigue siendo un desafío clínico complejo, ya que la mayoría de las herramientas disponibles para el monitoreo hemodinámico no han sido validadas en pacientes con EHCA.
Se propone la ecografía a pie de cama (POCUS) como una herramienta básica para evaluar el estado del volumen a pie de cama del paciente, pero sin embargo presenta ciertas limitaciones como la variabilidad interobservador y su uso dificultado en pacientes con ascitis significativa. Se han propuesto como otras opciones, el estudio del sedimento urinario o incluso la biopsia renal, pero todas ellas con marcadas limitaciones, que hacen que hoy en día continúe siendo esta evaluación del volumen intravascular un reto a resolver en los próximos años[3],[5],[15],[33],[34].
Evaluación de la función renal
La sCr es el marcador estipulado para establecer el criterio diagnóstico y grados de fracaso renal en el paciente cirrótico, aun así, es un marcador con ciertas limitaciones, como estar influenciado por la masa muscular, los cambios en el volumen de distribución o incluso las posibles interferencias con la bilirrubina. Limitaciones, que son frecuentes en el paciente cirrótico y pueden hacer que se retrase el diagnóstico de fracaso renal[34],[35].
En el último consenso de la ADQI-ICA, se propone el uso de la ecuación CKD-EPI sin la variable racial y empleando la cistatina C (CysC) en vez de sCr para evaluar la tasa de filtrado glomerular estimada en el paciente cirrótico, ya que nos permite una mejor estimación de la función renal con un menor sesgo asociado en estos pacientes[5],[36],[37].
Factores desencadenantes y fenotipificación de la IRA
Además del estudio de la función renal, en los últimos consensos sobre fracaso renal en el paciente cirrótico se aconseja la detección precoz de las posibles noxas desencadenantes de este fracaso renal[38].
Para dicha investigación, debemos basarnos en una correcta anamnesis sobre el paciente y apoyarnos de distintos marcadores bioquímicos; entre ellos, aquellos relacionados con el daño renal con el fin de facilitar la detección de la IRA, filiar el origen de esta y así poder dirigir con mayor precisión la estrategia terapéutica[5].
Como marcadores de daño estructural renal, se proponen el estudio de albúmina y proteínas en orina junto con la lipocalina gelatinasa de neutrófilos urinarios (uNGAL). El NGAL es un biomarcador con amplios estudios y prometedor, el cual no encontramos con facilidad en nuestros centros hospitalarios principalmente por su alto coste; que nos va a facilitar el diagnóstico diferencial entre necrosis tubular aguda y el origen prerrenal de la disfunción renal. Valores de NGAL ≥ 220 pg/d de creatina nos orientan a un origen estructural de la IRA[39]-[41].
Prevención
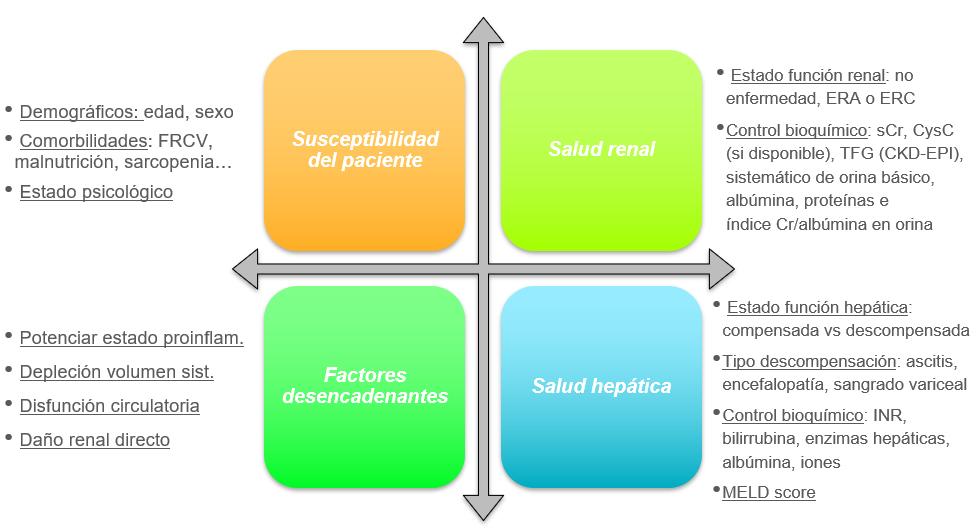
El desarrollo de disfunción renal en el paciente cirrótico es una complicación común y grave, por lo que es fundamental que en todo paciente con enfermedad hepática crónica avanzada se lleve a cabo una evaluación completa de la salud renal y hepática (Figura 3) basada en una anamnesis amplia en la que se valore la susceptibilidad del paciente en función de sus antecedentes para desarrollar IRA; el conocimiento de fármacos y eventos desencadenantes de dicha disfunción y ser conocedores de la función renal y hepática del paciente[5],[42][43].
Figura 3
Evaluación completa de la salud renal y hepática del paciente cirrótico. Adaptado de: Nadim MK, Kellum JA, Fomi L, et al. Acute kidney injury in patients with cirrhosis: Acute Disease Quality Initiative (ADQI) and International Club of Ascites (ICA) joint multidisciplinary consensus meeting. J Hepatol. 2024; 81: 163-83.
Tabla 3
Terapias vasoconstrictoras disponibles para el tratamiento del SHR-IRA: vías de administración, dosis, consejos para su uso y criterios de suspensión de esta.
En función de todo ello, y basados principalmente en los distintos eventos desencadenantes principales, desde la ADQI-ICA se proponen las siguientes estrategias para prevenir el desarrollo de IRA en el paciente cirrótico (Tabla)[5]:
Estrategia terapéutica general del fracaso renal agudo
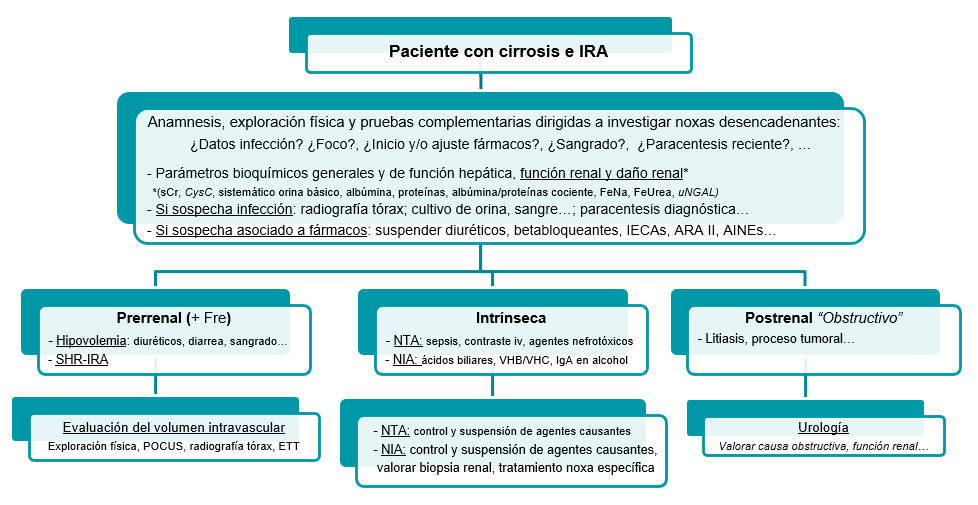
De forma general, en todo paciente con EHCA hepática y desarrollo de IRA se debe llevar a cabo una estrategia terapéutica basada en el conocimiento de la salud hepática y renal del paciente y del fenotipo de IRA que nos encontremos[5],[15]. Inicialmente llevaremos a cabo una valoración de la salud global del paciente, focalizados a nivel hepático y renal principalmente, procediendo a investigar cualquier evento desencadenante y su posterior corrección y/o suspensión en caso de ser necesario (Figura 4)[5],[15],[44].
Figura 4
Manejo inicial del paciente con enfermedad hepática crónica avanzada y disfunción renal aguda.
Una vez llevado a cabo este paso y la probable fenotipificación del origen causal de la disfunción, dirigiremos la terapia en base al fenotipo de IRA sospechado y manteniendo en todo momento un estado hemodinámico y volumétrico óptimo del paciente3,[5],[15]:
Intrínseca: se debe suspender cualquier agente nefrotóxico causante, y valorar en caso de no presentar una correcta evolución clínica la realización de biopsia renal.
En los casos concretos de patología glomerular específica, se debe valorar el empleo de tratamiento específico necesario para la misma, en consonancia con los especialistas oportunos.
Postrenal: se valorará la terapia a seguir en consonancia con el servicio de urología de nuestros centros, basándonos fundamentalmente en la causa obstructiva y función renal.
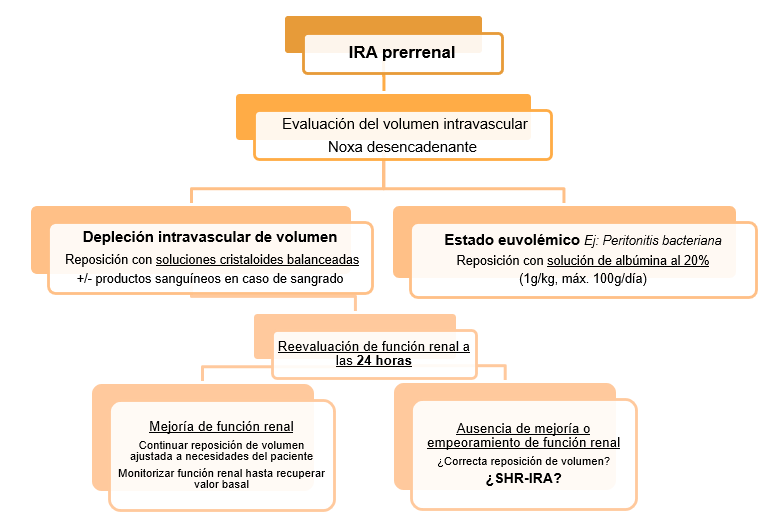
Prerrenal: se aconseja realizar de forma inicial una valoración global del estado de volumen del paciente, con el fin de poder llevar a cabo una correcta y segura recomposición del volumen sistémico, evitando así una sobrecarga iatrogénica de volumen (Figura 5).
En el último consenso de la ADQI-ICA, se recomienda el uso en primera línea de soluciones cristaloides balanceadas[45],[46] para la reposición de volumen en los pacientes con disfunción renal y requieran de reanimación de volumen; a excepción de que exista alguna indicación específica para el uso de otros líquidos. Aun así, aconsejamos que dicha elección de líquidos debe ser individualizada, en función de la condición específica del paciente[3].[5],[15],[47]:
Depleción intravascular de volumen: reposición con soluciones cristaloides balanceadas, asociando reposición con productos sanguíneos en caso de sangrado gastrointestinal.
Estado euvolémico (EJ: Peritonitis bacteriana): reposición con solución de albúmina al 20% a dosis de 1 g/Kg de peso (máximo de 100 g al día.
A las 24 horas de iniciar la reposición de volumen efectiva, se recomienda control de sCr:
Si mejoría de función renal: continuaremos con reposición de volumen ajustada a las necesidades del paciente y monitorización de función renal hasta conseguir valores aproximados al basal.
Ausencia de mejoría o empeoramiento de función renal: asegurarnos de reposición de volumen efectiva, y en caso de ser así, valorar criterios de SHR-IRA y plantearnos iniciar precozmente medidas para dicho fenotipo de IRA.
Estrategia terapéutica del SHR-IRA
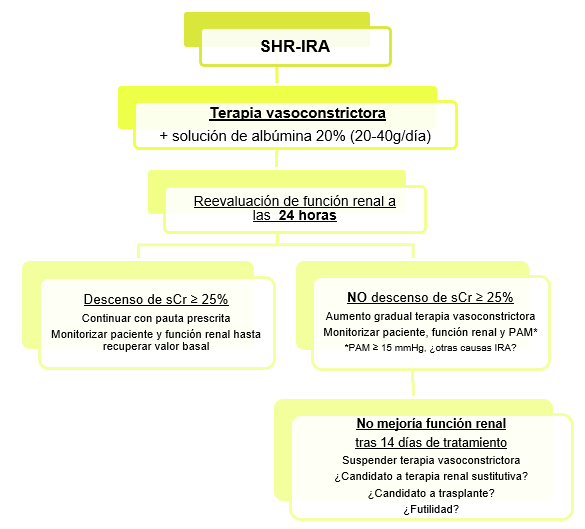
Una vez establecido el diagnóstico de sospecha de SHR-IRA, se debe iniciar en la mayor brevedad posible la terapia vasoconstrictora (terlipresina como agente de primera línea) (Tabla 4) en combinación con albúmina al 20% (20-40g al día)[5],[12],[49].
Tabla 4
Terapias vasoconstrictoras disponibles para el tratamiento del SHR-IRA: vías de administración, dosis, consejos para su uso y criterios de suspensión de esta.
Una vez iniciada dicha terapia, se aconseja una monitorización estrecha del paciente y control del volumen sistémico para evitar reacciones adversas[49]-[52]:
Eventos isquémicos (cardiacos, periféricos y/o mesentéricos), principalmente asociados a la terapia vasoconstrictora y que se suelen controlar con el uso en infusión frente a bolos de estos fármacos, o en ciertas ocasiones precisando de una reducción o incluso suspensión de estos.
Sobrecarga de volumen, la asociación de fármacos vasoconstrictores junto con la infusión intravenosa de albúmina favorece el aumento del volumen sistémico. Es por ello, que se recomienda una monitorización estrecha de este y en caso de presentar signos y/o síntomas sugestivos de sobrecarga hídrica se aconseja la suspensión temporal de albúmina, reducción de dosis de fármacos vasoconstrictores y valorar la coadministración de fármacos diuréticos.
A las 24 horas de iniciar dicha terapia, se aconseja la monitorización de sCr
:Descenso de sCr ≥ 25% respecto al previo: continuaremos con el tratamiento iniciado y monitorización del paciente y función renal hasta conseguir valores aproximados al basal.
NO descenso de sCr ≥ 25% respecto al previo: se recomienda aumento gradual de dosis de fármacos vasoconstrictores y monitorización continuada del paciente y función renal, hasta conseguir objetivo.
También se aconseja en esta situación, la monitorización de la presión arterial media (PAM), ya que se ha demostrado en diferentes estudios la mejoría de la función renal cuando se asocia un aumento de las cifras de PAM ≥ 15 mmHg en pacientes tratados con terapia vasoconstrictora. Es por ello por lo que, si dicho aumento de la PAM se produce sin asociar mejoría de la sCr, se deberían reevaluar causas alternativas de IRA[53],[54].
Se valorará la suspensión de terapia vasoconstrictora, en caso de que la función renal no mejore tras un máximo de 14 días de tratamiento o tras 48 horas con dosis máximas toleradas; se desarrollen eventos adversos graves o esté indicada iniciar otra terapia alternativa[5],[12].
Otras opciones terapéuticas
Terapia renal sustitutiva (TRS)
Se debe considerar el inicio temprano de TRS en pacientes cirróticos que desarrollen IRA y asocien eventos adversos refractarios al tratamiento médico dirigido; como por ejemplo hiperpotasemia, acidosis o sobrecarga de volumen intravascular que no responde a tratamiento diurético o no se puede corregir con diuréticos sin asociar eventos adversos graves, como alteraciones hidroelectrolíticas o encefalopatía hepática[55]-[57].
También se plantea como opción terapéutica puente a trasplante en pacientes con SHR-IRA que no responden a terapia vasoconstrictora o presentan eventos adversos severos a la misma, que precisan de su suspensión. En caso de que el paciente no sea candidato a trasplante hepático, la TRS se considera una terapia fútil, y su uso debe valorarse de forma individualizada[12].
Trasplante hepático (THO)
Los episodios de IRA se asocian con un alto riesgo de mortalidad a corto plazo en el paciente cirrótico, especialmente en aquellos con una puntuación MELD basal alta. Es por ello por lo que se recomienda una evaluación acelerada para THO en pacientes con EHCA descompensada tras superar un episodio de IRA.
En los pacientes que desarrollan SHR-IRA, el trasplante hepático es el tratamiento de elección y se debe valorar el mismo, independientemente de la respuesta a la terapia dirigida con vasoconstrictores. El trasplante simultáneo renal y hepático es una opción terapéutica potencial en los casos de pacientes candidatos a trasplante hepático que presentan una disfunción renal prolongada, ya que la recuperación de la función renal a posteriori es menos probable en estos pacientes que en aquellos con una duración más corta de la disfunción renal. En 2017, la Red de Obtención y Trasplante de Órganos estableció como criterios para el trasplante simultáneo de hígado y riñón, la duración prolongada de disfunción renal aguda (≥ 6 semanas), necesidad de terapia renal sustitutiva y la presencia de ERC[58]-[60].
Derivación portosistémica intrahepática transyugular (TIPS)
Actualmente no existe evidencia suficiente a favor de la implantación de TIPS para el tratamiento de la IRA[3],[5],[12]. Existen varios ensayos clínicos en marcha para aportar evidencia al beneficio de esta terapia en la disfunción renal del paciente cirrótico[61]-[64]. Destacando el resultado, de un metaanálisis, que sugiere que la implantación del TIPS conduce a una mejoría significativa en la función renal en los pacientes cirróticos con SHR-IRA; ya que permite mejorar la función renal al redistribuir el volumen sanguíneo sistémico y reducir así la presión portal[65].
Seguimiento ambulatorio
El periodo ulterior al alta hospitalaria tras un fracaso renal agudo en el paciente cirrótico es un momento crítico en el que los cambios dinámicos que se producen sobre la función hepática y renal pueden determinar el pronóstico de vida del paciente. De hecho, tras este episodio de hospitalización, estos pacientes presentan un mayor riesgo asociado de episodios recurrentes de IRA, progresión a ERC, dependencia de terapia renal sustitutiva y morbimortalidad[66]-[70].
Se aconseja que, al mes, como mínimo, del alta hospitalaria se proceda a la reevaluación de la salud renal y hepática del paciente cirrótico, para confirmar así el grado de recuperación o progresión de la enfermedad renal. En dicha valoración, se aconseja evaluar la función hepática del paciente con scores pronósticos habituales y la función renal incluyendo determinación de sCr, niveles séricos de CysC (aporta valores más fidedignos del estado de la función renal) si están disponibles y detección de albúmina y proteínas en orina. Estos últimos valores, han demostrado en varios estudios que nos ayudan a identificar a aquellos pacientes que presentan un mayor riesgo de progresión a ERC.
En esta evaluación también tendremos que basarnos en continuar con las medidas preventivas para el cuidado de la función renal y hepática del paciente, basándonos en los elementos claves ya mencionados anteriormente (Figura 3); siendo un pilar fundamental en estas valoraciones la conciliación terapéutica con el paciente sobre todo con fármacos diuréticos y betabloqueantes, con el fin de establecer un equilibrio entre la función renal y la hepática[71]-[74].
En los casos de disfunción renal persistente a los 90 días, estos pacientes deben ser evaluados formalmente sobre el posible desarrollo o progresión a ERC; siendo estos pacientes subsidiarios de un abordaje multidisciplinar y focalizado en función de su pronóstico de vida y estado de salud hepatorrenal, sobre si serían candidatos a plantear un proceso de trasplante o por el contrario, precisan de un manejo integral donde los cuidados paliativos juegan un papel fundamental en el seguimiento y planificación de la atención del paciente[5],[75],[76].
Conclusiones
- La insuficiencia renal aguda (IRA) es una complicación común en pacientes con enfermedad hepática crónica avanzada (EHCA), con una prevalencia variable de hasta el 53% en pacientes con EHCA descompensada, y un marcador de morbimortalidad elevada y de progresión hacia enfermedad renal crónica post-trasplante.
- Los criterios diagnósticos para la IRA han evolucionado, incorporando la disminución de la producción de orina como un criterio complementario, lo que refleja un esfuerzo por adelantar la detección y el manejo de la IRA en la población cirrótica.
- La etiología de la IRA en pacientes cirróticos es multifactorial, con causas que incluyen factores prerrenales, intrínsecos y postrenales, siendo la hipoperfusión renal y el síndrome hepatorrenal (SHR) particularmente prevalentes.
- El SHR se ha redefinido y clasificado más apropiadamente en SHR-IRA, SHR-ERA y SHR-ERC, basado en una evaluación detallada que incluye la ausencia de respuesta a una correcta expansión de volumen en 24 horas, preferiblemente con soluciones cristaloides balanceadas, y la ausencia de evidencia sólida para una explicación alternativa como causa primaria del fracaso renal.
- La fisiopatología de la IRA en el contexto de la EHCA es compleja e involucra disfunciones circulatorias sistémicas, vasoconstricción renal, disfunción cardíaca y estados proinflamatorios, todos ellos influenciados por la hipertensión portal y sus consecuencias hemodinámicas.
- La prevención de la IRA debe estar basada en una evaluación integral de la salud renal y hepática, así como en el conocimiento y manejo de los factores desencadenantes de disfunción renal.
La estrategia terapéutica para el manejo de la IRA en pacientes cirróticos debe ser personalizada y dirigida en función de la etiología sospechada, siendo fundamental en ello la corrección y/o suspensión de la noxa desencadenante, la evaluación y reposición de volumen y la valoración posterior precoz de terapias alternativas: terapia vasoconstrictora si desarrollo de SHR-IRA, terapia renal sustitutiva y/o trasplante hepático y/o renal simultáneo.
- El seguimiento ambulatorio es crucial para la reevaluación de la salud renal y hepática después de un episodio de IRA, con énfasis particular en la prevención de la progresión a enfermedad renal crónica, el ajuste de la terapia diurética y betabloqueante, y la planificación de la atención en caso de disfunción renal persistente.

 Descargar número completo
Descargar número completo Download full issue
Download full issue